Beyin Tümörü için Yeni Bir Akıllı İlaç – Vorasidenib ASCO 2023'te Dikkatleri Çekti
Beyin tümörleri, ülkemizde her yıl 6 binden fazla yeni vaka ile en sık görülen 12. kanser türüdür. Bu tümörlerin %30-35'i gliom olarak adlandırılan türdendir. Gliomlar, beynin destekleyici doku hücrelerinden, yani glial hücrelerden kaynaklanan bir beyin tümörü türüdür. Her yaşta görülebilmekle birlikte, çoğunlukla yetişkinlerde görülür. Gliomların çeşitli türleri bulunmakta olup, bunlar genellikle hücre tipine, konumuna ve derecesine (yani ne kadar hızlı büyüdüğüne ve yayıldığına) göre sınıflandırılır. Gliomlar, belirtileri ve tedaviye yanıtları büyük ölçüde değişkenlik gösterebilir. Standart tedavi yaklaşımları genellikle cerrahi, radyasyon tedavisi ve kemoterapiyi içerir.
Bu tümörler derecelerine göre ifade edilir ve derecelendirme, büyüme ve yayılma hızlarına bağlıdır. Dört farklı gliom derecesi vardır:
-
Derece I (Düşük Dereceli): Bu tümörler en az agresif olanlardır. Daha yavaş büyürler ve daha net bir sınırı vardır, bu da cerrahların onları daha kolay çıkarabilmesini sağlar. Derece I gliomlar genellikle çocuklarda görülür.
-
Derece II: Bu tümörler yine düşük dereceli sayılır ancak biraz daha hızlı büyürler ve daha az belirgin sınırları vardır. Ayrıca, zamanla daha yüksek dereceli tümörlere dönüşme eğilimindedirler.
-
Derece III: Bu tümörler yüksek dereceli ve daha agresiftir. Hızla büyürler ve çevredeki normal beyin dokusuna yayılırlar.
-
Derece IV (Glioblastoma): Bu tümörler en agresif ve en hızlı büyüyen gliomlardır. GBM veya GMB-IV olarak da adlandırılırlar. Çevreleyen beyin dokusuna hızla yayılırlar ve genellikle tedaviye dirençlidirler.
Derecelendirme ile birlikte gliomların biyolojisi hakkında bize en önemli bilgiyi IDH mutasyon durumu verir.
İzositrat dehidrogenaz (IDH) enzimi, normal hücre metabolizmasında önemli bir rol oynar. İki ana türü vardır: IDH1 ve IDH2. Bu enzimlerin genlerinde meydana gelen mutasyonlar, özellikle beyin tümörleri ve belirli türdeki lösemilerde yaygındır.
IDH1 genindeki mutasyonlar, özellikle düşük dereceli gliomlar ve ikincil glioblastomalar gibi beyin tümörlerinin büyük bir kısmında sıkça görülür. IDH2 genindeki mutasyonlar daha az yaygındır ve genellikle IDH1 mutasyonlarına göre daha düşük bir sıklıkta bulunur.
Örneğin, grade 2 gliomaların yaklaşık %80'inde IDH1 mutasyonları bulunurken, IDH2 mutasyonları yalnızca yaklaşık %4'te görülür. Bu durum, IDH1/2 mutasyonlarının beyin tümörlerinin genetik özelliklerinin anlaşılmasında önemli bir rol oynadığını ve potansiyel tedavi hedefleri olarak hizmet ettiğini göstermektedir. Tümörlerde IDH mutasyon durumu immünohistokimyasal (IHK), PCR (polimeraz zincir reaksiyonu) veya NSG (kapsamlı genomik dizileme) yöntemleri ile test edilebilir.
Bu bağlamda, IDH1 ve IDH2 mutasyonlarını taşıyan belirli bir tür gliom olan hastalar için oral hedefli bir ilaç olan vorasidenib, büyük bir umut olabilir. Bu ilaç, daha fazla yan etkiye sahip olan kemoterapi ve radyasyon yerine kullanılabilecek bir seçenektir.
Etki Mekanizması
Vorasidenib, IDH1 ve IDH2 enzimlerinin ikili baskılayıcısıdır. Normalde, bu enzimler, vücutta enerji üretimine yardımcı olan bir metabolit olan isositratı alfa-ketoglutarata (α-KG) dönüştürürler. Ancak, bazı kanser hücrelerinde bu enzimler mutasyona uğrayabilir ve α-KG yerine 2-hidroksiglutarat (2-HG) üretebilirler, bu da hücrelerin kontrolsüz bir şekilde büyümesine ve bölünmesine neden olur. Vorasidenib, bu mutasyonlu enzimlerin aktivitesini baskılayarak 2-HG'nin üretimini azaltır ve böylece kanser hücrelerinin büyümesini ve bölünmesini durdurabilir.
2. Dereceli Gliomlar için İlk Potansiyel Akıllı İlaç
INDIGO adlı bir faz 3 klinik araştırma vorasidenibin etkinliğini değerlendirdi. Çalışma, Kuzey Amerika, Avrupa ve Orta Doğu'daki 77 merkezde 331 hastayı içeriyordu.
Çalışma 4 Haziran'da ASCO 2023 Kongresi'nde sunuldu ve eş zamanlı olarak NEJM dergisinde yayımlandı.
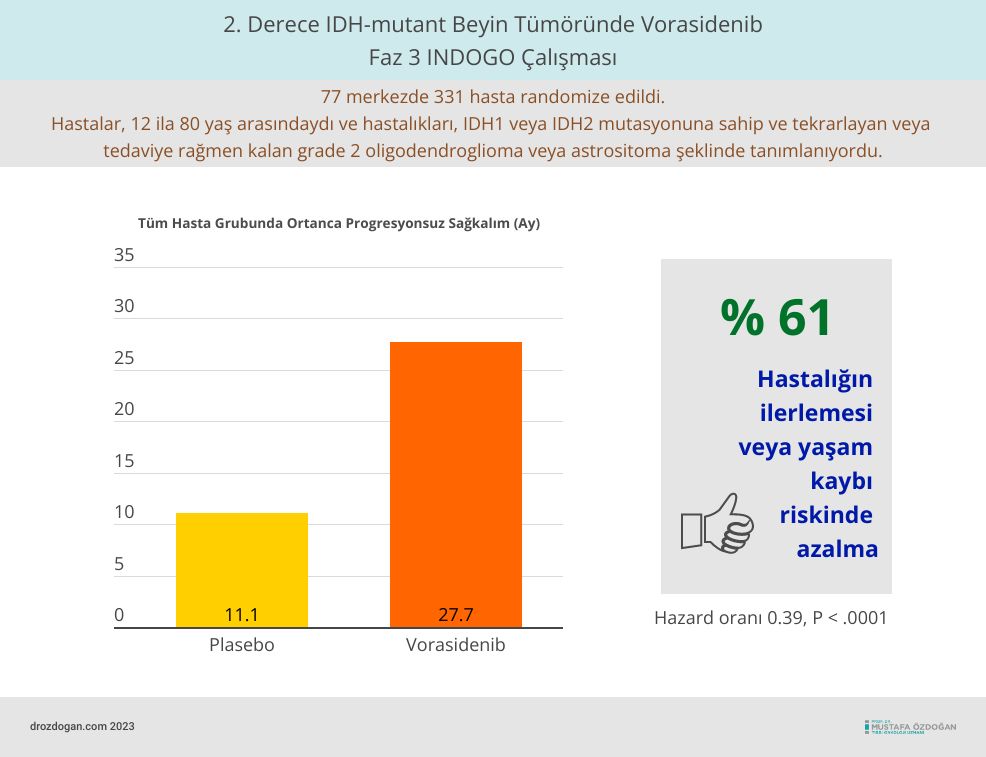
- Hastalar, 12 ila 80 yaş arasındaydı ve hastalıkları, IDH1 veya IDH2 mutasyonuna sahip ve tekrarlayan veya tedaviye rağmen kalan grade 2 oligodendroglioma veya astrositoma şeklinde tanımlanıyordu.
- Klinik araştırma süresince, hastalar 28 günlük döngüler halinde günlük 40 mg vorasidenib veya plasebo alacak şekilde rastgele gruplara ayrıldılar. 2022 Eylül'ündeki veri kesme noktasında, klinik araştırmaya katılan 331 hastanın 226'sı (%68.3) tedaviye devam ediyordu.
- Çalışma sonucuna göre, vorasidenib alan hastalarda ortanca progresyonsuz (ilerlemesiz) sağkalım (PFS) süresi 27.7 ayken, plasebo alan hastalarda bu süre 11.1 aydı. Bu, vorasidenib kullanan hastaların, hastalıklarının ilerlemesini plasebo alanlara kıyasla ortalama 16.6 ay daha uzun süre engelleyebildiklerini gösteriyor. Ayrıca, vorasidenib ile hastalığın ilerlemesi veya yaşam kaybı riski, plaseboya kıyasla %61 azalmıştı (Hazard oranı 0.39, P < .0001).
-
Vorasidenib'in sık görülen yan etkileri arasında karaciğer enzimlerinde artış, yorgunluk, baş ağrısı, ishal ve bulantı bulunmaktadır. Vorasidenib grubunda %9.6'lık bir oranda, plasebo grubunda görülmeyen, derece 3 veya 4 alanin aminotransferaz artışı görülmüştür.
Sonuç olarak vorasidenib, tümör ilerlemesi riskini %61 azaltma potansiyeli sunan bir ağızdan alınan, hedefe yönelik tedavi sağlar. Bu, bu hastalığın tedavi yaklaşımını önemli ölçüde değiştirme potansiyeli olan belirgin bir etkililik göstergesidir.
Bu ilacın kullanımının, hastaların yaşam kalitesini korurken diffüz gliomanın doğal seyrini değiştirme potansiyeline sahip olduğu belirtiliyor. Bu, IDH-mutant derece 3 gliomları olan hastalar ve erken ilerleme riski yüksek olan IDH-mutant derece 2 tümörleri olan hastalar için bir umut olabilir.
Sonuç olarak, bu yeni oral ilaç vorasidenib, beyin tümörlerine karşı mücadelede önemli bir gelişme sunmaktadır. Araştırmacılar, ilacın etkinliğini ve güvenliğini belgelemeye devam ettikçe, bu ilacın geniş çaplı kullanımı için düzenleyici onay elde edilebilir. Bu tedavi stratejisi, tedavi manzarasını değiştirme potansiyeli taşıyan ve gliom hastalarının yaşam kalitesini korumalarına yardımcı olabilecek bir umudu temsil ediyor.
Ingo K. Mellinghoff, Martin J. van den Bent, Deborah T. Blumenthal, et al. Vorasidenib in IDH1- or IDH2-Mutant Low-Grade Glioma. NEJM 4 June 2023