Over (kadın yumurtalık) kanseri, kadınların dünya genelinde karşılaştığı önemli bir sağlık sorunudur. Bu kanser türü genellikle ileri evrelerde teşhis edilir. Yumurtalık kanserinin tedavisindeki en büyük zorluklardan biri, hastaların çoğunda ana tedavi sonrası kanserin tekrarlaması, zamanla kemoterapiye dirençli hale gelmesi ve hali hazırda bulunan tedavi seçeneklerinin genellikle sınırlı ve geçici etkinliğe sahip olmasıdır. Bu nedenle, daha etkili ve tolere edilebilir tedavi stratejilerinin bulunması, yumurtalık kanserinden etkilenen kadınlar için hayati önem taşımaktadır.
Son 20 yılda over kanseri tedavisindeki en önemli ilerlemeyi, bir PARP inhibitörü olan ve 2014'te FDA tarafından onaylanan olaparib (Lynparza) temsil ediyor. Olaparibin bu başarısı, diğer PARP inhibitörlerinin de FDA onay sürecinden geçmesine yol açtı. Ancak 2020 yılından sonra, farklı ilaç sınıflarının ve çeşitli kombinasyon tedavilerinin ön plana çıktığını görmeye başladık. Bu yeni yaklaşımlar, over kanseri tedavisindeki gelişmeleri hızlandırma potansiyeli taşıyor ve hastalar için daha umut verici tedavi seçenekleri sunuyor.
ASCO 2023 Kongresi’nde sunulan MIRASOL, DUO-O ve RAMP 201 gibi klinik çalışmaların sonuçları, over kanserli hastalar için umut verici gelişmeler olarak karşımıza çıkmaktadır. Bu klinik denemeler, mevcut tedavi seçeneklerini geliştirmek veya yeni tedavi yaklaşımları bulmak için yapılan önemli adımlardır.
MIRASOL Çalışması
MIRASOL çalışması, platin-bazlı kemoterapilere dirençli, ileri evre yüksek dereceli epitel yumurtalık, primer peritoneal veya fallop tüpü kanseri olan ve yüksek folat reseptör alfa (FRα) ekspresyonuna sahip hastalarda mirvetuximab soravtansinin (Elahere) etkinliğini ve güvenliğini değerlendiren bir faz 3 klinik denemedir. Çalışma, 2023 ASCO Yıllık Toplantısı'nda sunulan dikkat çekici çalışmalardan biridir.
Not: Immunogen adlı firma tarafından geliştirilen mirvetuximab soravtansine-gynx etken maddeli Elahere adlı ilaç, SORAYA klinik çalışması sonuçlarına göre, platin-bazlı kemoterapiye direnç gelişmiş, daha önce 1 ila 3 basamak tedavi almış, folat reseptörü-alfa (FRa) pozitif, ileri evre epitelyal over, fallop tüpü veya primer periton kanserli hastaların tedavisi için 14 Kasım 2022’de hızlandırılmış FDA (ABD Gıda ve İlaç İdaresi) onayı almıştı. Elahere, platin dirençli over kanseri için FDA tarafından onaylanan ilk antikor-kemoterapi konjugatıdır.
MIRASOL çalışmasının sonuçları, mirvetuximab soravtansinin, araştırmacının kemoterapi seçeneği ile karşılaştırıldığında progresyonsuz (ilerlemesiz) sağkalım (PFS) ve genel sağkalım (GS) süresini önemli ölçüde artırdığını göstermiştir. Mirvetuximab soravtansin alan hastalar için ortanca PFS süresi 13.8 ayken, kemoterapi alan hastalar için bu süre 4.8 aydı. Mirvetuximab soravtansin alan hastalar için ortanca GS süresi henüz belirlenememişken, kemoterapi alan hastalar için bu süre 21.9 aydı.
MIRASOL çalışmasının sonuçları, platin dirençli yumurtalık kanserinin tedavisinde önemli bir ilerleme anlamına gelmektedir. Mirvetuximab soravtansin, bu hasta grubunda PFS ve GS'de istatistiksel olarak anlamlı bir iyileşme gösteren ilk ilaçtır. İlaç şimdi, platin duyarlı yumurtalık kanseri için birinci basamak tedavi olarak bir faz 3 denemesinde değerlendiriliyor.
İşte çalışma hakkında birkaç ek detay:
- Çalışmaya, yüksek FRα (folat reseptörü-alfa) ekspresyonuna sahip platin dirençli, ileri evre yüksek dereceli epitel yumurtalık, primer peritoneal veya fallop tüpü kanseri olan 453 hasta kaydedildi.
- Hastalar, ya mirvetuximab soravtansin (6 mg/kg, düzeltilmiş ideal vücut ağırlığı, 21 günlük döngünün 1. günü) ya da kemoterapi (paklitaksel, pegylated liposomal doxorubicin veya topotecan) alacak şekilde randomize edildi.
- Çalışmanın birincil sonlanım noktası progresyonsuz sağkalım idi.
- Çalışmanın ikincil sonlanım noktaları arasında genel sağkalım, mirvetuximab soravtansinin güvenlik profili ve hastaların yaşam kalitesi vardı.
| Sonuç | Mirvetuximab soravtansin | Araştırmacı tarafından seçilen kemoterapi | |
| Objektif yanıt oranı | %42 | %16 | |
| Ortanca progresyonsuz sağkalım | 5.62 ay | 3.98 ay | |
| Tehlike oranı= 0.65 (p< 0.0001) | |||
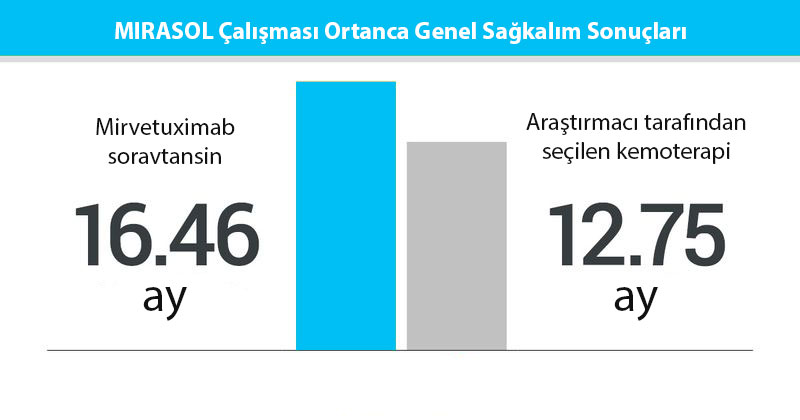
| Ortanca genel sağkalım | 16.46 ay | 12.75 ay | |
| Tehlike oranı= 0.67 (p< 0.0046) | |||
MIRASOL çalışmasının sonuçları, platin dirençli yumurtalık kanseri için yeni tedavilerin geliştirilmesinde önemli bir adımı temsil ediyor. Mirvetuximab soravtansine, bu agresif hastalığa sahip hastaların sonuçlarını iyileştirme potansiyeline sahip umut verici bir yeni ilaçtır.
DUO-O Çalışması
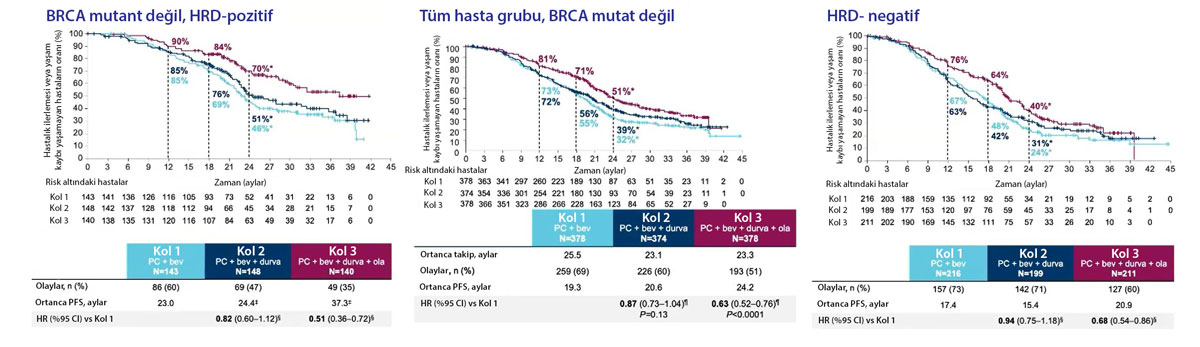
DUO-O denemesi, yeni tanı almış ileri evre yumurtalık kanseri olan ve BRCA mutasyonu “olmayan” hastalarda, standart tedavi artı durvalumab (Imfinzi) ve olaparib (Lynparza) kombinasyonunun etkinliğini ve güvenliğini değerlendiren bir faz 3 klinik denemedir. Çalışma, 2023 ASCO Yıllık Toplantısı'nın dikkat çeken bir diğer çalışmasıdır.
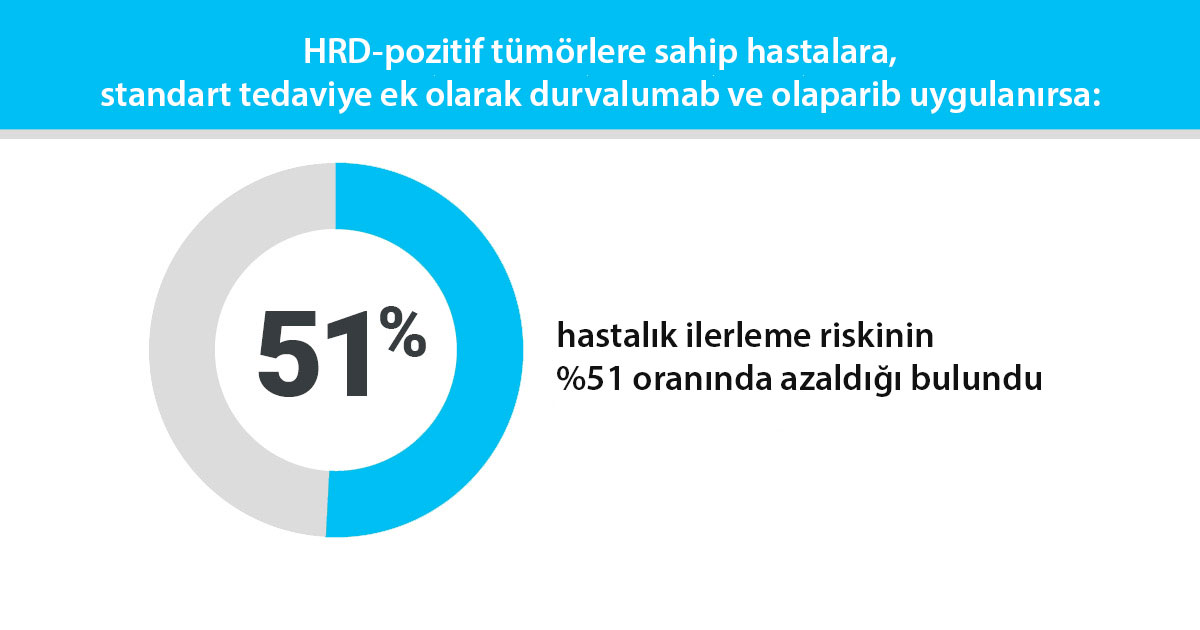
Çalışmanın ara sonuçları, durvalumab ve olaparib kombinasyonunun, sadece standart tedavi alan hastalarla karşılaştırıldığında ilerlemesiz sağkalım (PFS) süresini önemli ölçüde artırdığını göstermiştir. Kombinasyon tedavisi alan hastalar için ortanca PFS süresi 20.2 ayken, sadece standart tedavi alan hastalar için bu süre 11.9 aydı.
Kombinasyon tedavisi, genel sağkalım süresinin de iyileşme eğilimi gösterdi, ancak henüz kesin sonuçlar çıkarılacak kadar olgun veri bulunmamaktadır.
Kombinasyon tedavisinin güvenlik profili genellikle iyi tolere edildi. En yaygın yan etkiler yorgunluk, bulantı ve kusma idi.
DUO-O denemesinin sonuçları, BRCA mutasyonu olmayan ileri evre yumurtalık kanserinin tedavisinde önemli bir gelişme anlamına gelmektedir. Durvalumab ve olaparib kombinasyonunun, bu hasta grubunda progresyonsuz ve belki de genel sağkalımı yileştirmenin güvenli ve etkili bir yolu olduğu görülmektedir.
İlgili konu: HRD Nedir? Nasıl Test Edilir ve Kanserde Önemi
İşte çalışma hakkında birkaç ek detay:
- Çalışmaya, yeni tanı almış ileri evre yumurtalık kanseri olan ve BRCA mutasyonu olmayan 1,130 hasta kaydedildi.
- Hastalar, ya durvalumab (her 2 haftada bir 10 mg/kg) ve olaparib (günde iki kez 300 mg) kombinasyonunu standart tedavi ile (paklitaksel/karboplatin ve bevasizumab) veya sadece standart tedaviyi alacak şekilde randomize edildi.
- Çalışmanın birincil sonlanım noktası progresyonsuz sağkalım idi.
- Çalışmanın ikincil sonlanım noktaları arasında genel sağkalım, kombinasyon tedavisinin güvenlik profili ve hastaların yaşam kalitesi vardı.
DUO-O denemesinin sonuçları, ileri evre yumurtalık kanseri için yeni tedavilerin geliştirilmesinde önemli bir adımı temsil etmektedir. Bu bulguları doğrulamak için daha fazla veriye ihtiyaç olacaktır, ancak DUO-O denemesinin sonuçları umut vericidir.
RAMP 201 Çalışması
RAMP 201 çalışması, tekrarlayan düşük dereceli seröz over kanseri (DDSOK) olan hastalarda avutometinib (VS-6766) ile defactinib kombinasyonunun etkinliğini ve güvenliğini değerlendiren bir faz 2 klinik denemesidir. Çalışma, 2023 ASCO Yıllık Toplantısı'nda bir poster tartışma oturumunda sunulmuştur.
Çalışmanın A kısmından gelen ara sonuçlar, avutometinib ve defactinib kombinasyonunun, daha önce yoğun şekilde tedavi görmüş tekrarlayan DDSOK hastalarında doğrulanmış objektif yanıt oranının %28 olduğunu göstermiştir. Ortanca progresyonsuz sağkalım süresi henüz belirlenememiş, ancak ortanca yanıt süresi 10.4 aydı.
Avutometinib ve defactinib, aynı sinyal yolunun, yani MAPK yolunun farklı bölümlerini hedef alarak çalışır. MAPK yolakları, hücre yüzeyinden çekirdeğe sinyaller ileten bir protein serisidir. Bu sinyaller, hücre büyümesi, diferansiyasyon ve apoptoz (programlanmış hücre ölümü) gibi birçok önemli hücresel süreci kontrol eder.
Avutometinib, bir RAF/MEK inhibitörüdür. RAF adı verilen bir proteinin aktivitesini bloke ederek çalışır. RAF, hücre büyümesini ve çoğalmasını kontrol eden başka bir protein olan ERK'yi aktive eden MEK'i aktive eder. RAF'ın aktivitesini engelleyerek, avutometinib, ERK'nin aktivasyonunu önleyebilir ve hücre büyümesini inhibe edebilir.
Defactinib ise bir FAK inhibitörüdür. FAK, hücre yapışması ve göçünde rol alan bir proteindir. FAK'ın aktivitesini engelleyerek, defactinib kanser hücrelerinin yayılmasını önleyebilir.
Avutometinib ve defactinib, meme kanseri, over kanseri ve akciğer kanseri dahil olmak üzere çeşitli kanserlerin tedavisi için klinik denemelerde incelenmektedir. Bu denemelerin sonuçları henüz mevcut değildir, ancak bu ilaçların etkinliği ve güvenliği hakkında önemli bilgiler sağlaması beklenmektedir.
RAMP 201 çalışmasının genel yanıt oranı sonuçları aşağıdadır:
| Hasta grubu | Avutometinib artı defactinib | Sadece avutometinib |
| Tüm hastalar | %45 | %10 |
| KRAS-mutant | %60 | %7 |
| KRAS-wild | %29 | %0 |
Çalışmada yeni güvenlik sinyalleri gözlemlenmedi ve çoğu yan etki hafif ila orta derecede idi. En yaygın yan etkiler yorgunluk, bulantı ve kusma idi.
RAMP 201 çalışmasının ara sonuçları umut verici olup, avutometinib ile defactinib kombinasyonunun tekrarlayan LGSOC hastaları için umut vaat eden yeni bir tedavi seçeneği olabileceğini düşündürmektedir. Çalışma devam etmekte olup, gelecekte daha fazla veri elde edilecektir.
İşte çalışma hakkında birkaç ek detay:
- Çalışmaya, daha önce en az iki basamak tedavi almış tekrarlayan DDSOK olan 69 hasta kaydedildi.
- Hastalar, ya avutometinib (günde iki kez 300 mg) veya plasebo ile defactinib (günde iki kez 100 mg) alacak şekilde randomize edildi.
- Çalışmanın birincil sonlanım noktası objektif yanıt oranı idi.
- Çalışmanın ikincil sonlanım noktaları arasında ortanca progresyonsuz sağkalım, yanıt süresi ve kombinasyon tedavisinin güvenlik profili vardı.
RAMP 201 çalışmasının sonuçları, tekrarlayan DDSOK için yeni tedavilerin geliştirilmesinde önemli bir adımı temsil etmektedir. Avutometinib ve defactinib kombinasyonu, bu agresif hastalığa sahip hastalar için güvenli ve etkili bir tedavi seçeneği gibi görünmektedir. Bu bulguları doğrulamak için daha fazla veriye ihtiyaç olacaktır, ancak RAMP 201 çalışmasının sonuçları umut vericidir.
HİPEK Çalışmaları
Hipertermik İntraPeritoneal Kemoterapi (HİPEK, İngilizce'si HIPEC= Hyperthermic IntraPeritoneal Chemotherapy), belirli kanser türlerinin tedavisinde kullanılan özel bir tedavi yöntemidir. Genellikle peritoneal (karın içi) yayılım gösteren kanserler için kullanılır, bu kanser türleri arasında over (yumurtalık) kanseri, kolon kanseri, mide kanseri ve mezotelyoma gibi türler bulunur.
HIPEC uygulaması genellikle iki aşamadan oluşur. İlk aşama, cerrahi olarak mümkün olduğunca çok tümörün çıkarılmasıdır, bu işleme "sitoredüktif cerrahi" denir. İkinci aşamada, kemoterapi ilaçları direkt olarak karın boşluğuna uygulanır. Bu ilaçlar, normal vücut sıcaklığının üzerinde bir sıcaklıkta (yaklaşık 42°C) uygulanır, bu da ilaçların kanser hücrelerine daha etkili bir şekilde nüfuz etmesine ve bu hücreleri öldürmesine yardımcı olabilir. Bu iki aşamalı yaklaşım, hem büyük tümörleri çıkarmayı hem de kalan mikroskopik kanser hücrelerini öldürmeyi hedefler.
Over kanseri genellikle ilerlemiş bir aşamada teşhis edilir ve bu aşamada hastalık genellikle peritone içerisine yayılmıştır. HIPEC, bu yayılmış kanser hücrelerini hedefleyerek hastalar için olası bir tedavi seçeneği sunabilir.
Ancak, HIPEC tedavisinin etkinliği ve yan etkileri hakkında daha fazla araştırmaya ihtiyaç vardır. Bazı çalışmalar, HIPEC'in hayatta kalma sürelerini uzattığını gösterirken, bazıları bu tedavinin yan etkileri ve maliyeti nedeniyle uygulamanın geniş çapta yayılmasını sınırlamıştır. ASCO 2023'te over kanserinde HIPEC kullanımı değerlendiren 2 dikkat çekici çalışma sunulmuştur.
OVHIPEC-1 Çalışması
Faz-3 OVHIPEC-1, HIPEC'in ilk randomize klinik denemesidir ve yeni tanı alan evre 3 over kanserli hastaları kapsıyordu. Aşağıda on yıllık takip sonuçlarını görüyoruz.
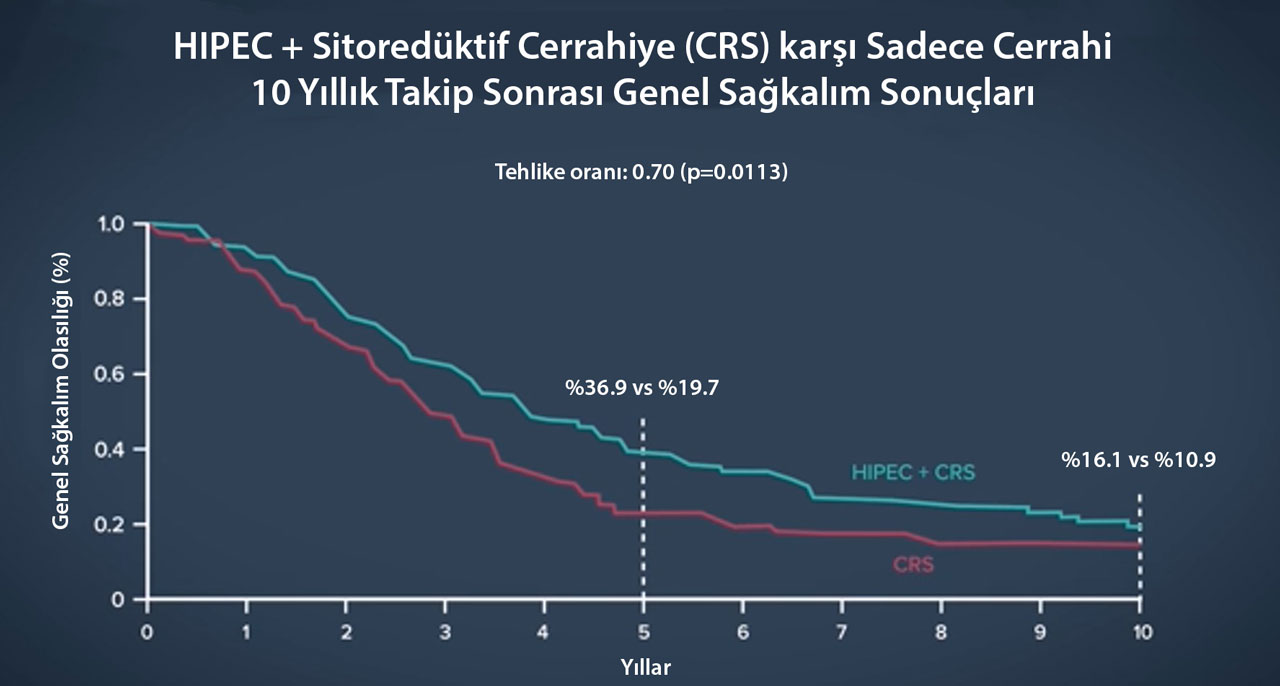
0.7 risk oranı ile genel hayatta kalma süresinde bir avantaj görüldü ve ortanca genel hayatta kalma süresi yüzde 30'luk bir iyileşme ile 33 aydan 44.9 aya çıktı.
CHIPOR Çalışması
CHIPOR çalışması, HIPEC'in ilk platin duyarlı nüksüne yönelik yapılan bir faz 3 randomize klinik deneme. Bu çalışmada, hastaların kemoterapiye nasıl yanıt verdiği ve sonrasında HIPEC uygulaması ile ya da uygulamasız şekilde ameliyat olup olmadıkları incelendi. Bu denemeye 400'den fazla kadın hastanın katılımı sağlandı. Denemenin sonuçları, genel hayatta kalma süresinde 0.69 risk oranı ile bir iyileşme olduğunu ortaya koydu.
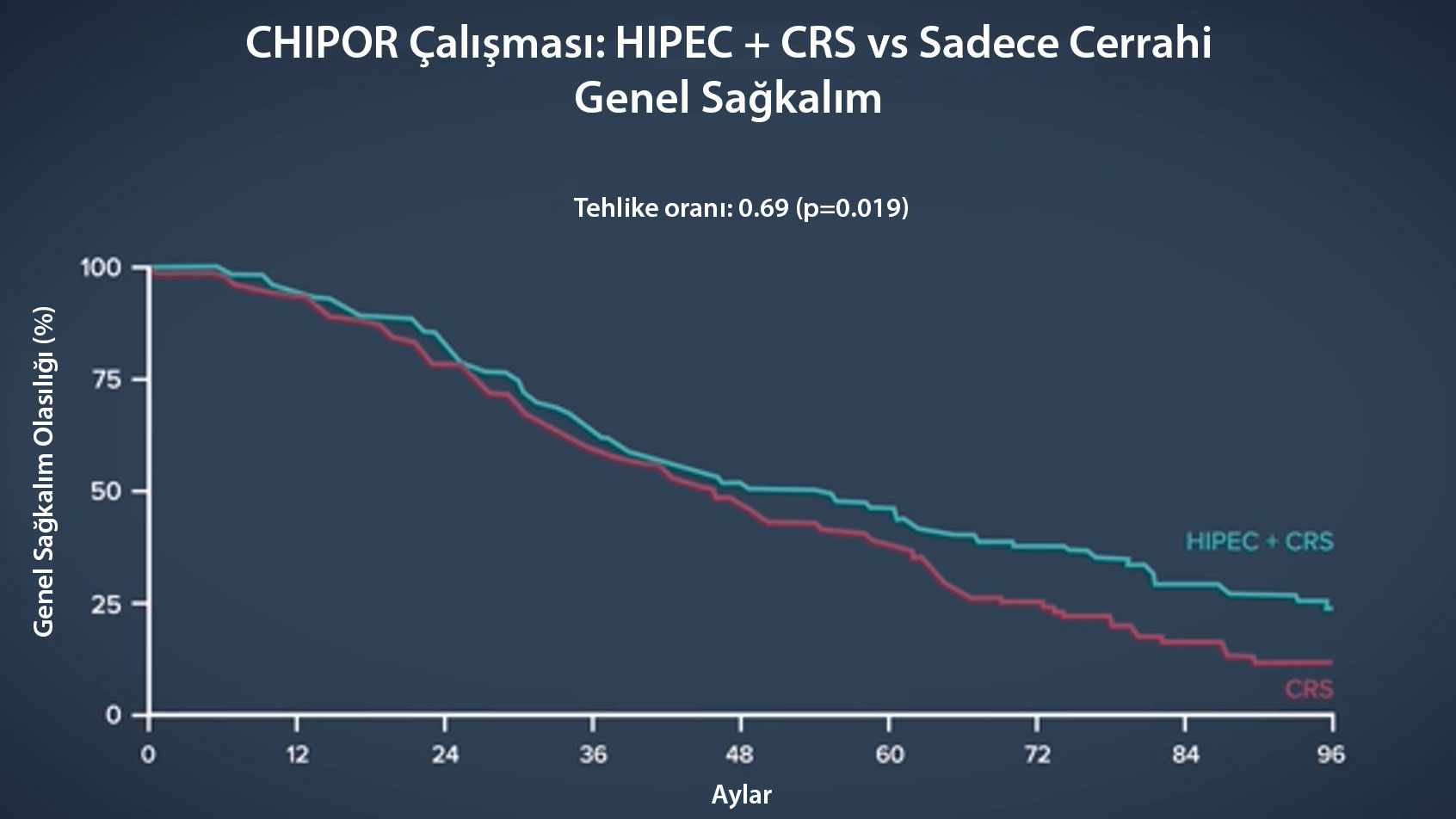
Dolayısıyla, iki çalışma bir araya getirildiğinde, HIPEC'in over kanseri tedavilerinin erken dönemlerinde gerçekten önemli bir rolü olabilir. Bu sunumların tam metin yayınları görülmeli. Ayrıca standart tedaviye ek olarak bevasizumab ve PARP inhibitörleri çağında olduğumuzu belirtmemiz gerekiyor.