Kemoterapiye Dirençli Over (Yumurtalık) Kanserinde İlk Kez Bir Akıllı İlaç FDA Onayı Aldı
Immunogen adlı firma tarafından geliştirilen mirvetuximab soravtansine-gynx etken maddeli Elahere adlı ilaç, platin-bazlı kemoterapiye direnç gelişmiş, daha önce 1 ila 3 basamak tedavi almış, folat reseptörü-alfa (FRa) pozitif, ileri evre epitelyal over (kadın yumurtalık), fallop tüpü veya primer periton kanserli hastaların tedavisi için 14 Kasım 2022’de hızlandırılmış FDA (ABD Gıda ve İlaç İdaresi) onayı aldı.
Elahere, platin dirençli over kanseri için FDA tarafından onaylanan ilk antikor-kemoterapi konjugatıdır.
Bu onay, daha önce bevasizumab (Altuzan, Mvasi, Zirabev) kullanımına bakılmaksızın, önceden bir ila üç sistemik tedavi rejimi alan ve tümörlerinde folat reseptörü-alfa (FRa) pozitifliği olan hastaları kapsar.
Over Kanserinde FRa Pozitiflik Oranı %35-40
FDA aynı tarihte ayrıca, Roche tarafından geliştirilen Elahere ile tedaviye uygun hastaların belirlenmesine yardımcı olan yardımcı teşhis aracı olan Ventana FOLR1 RxDx Testinin onayını da verdi. Yumurtalık kanseri hastalarının yaklaşık %35-40'ı FRa yönünden anlamlı derecede pozitiftir: bu 2+ yoğunlukta, tümör hücrelerinin %75’inin veya daha fazlasının boyandığı anlamına gelir. Test, taze veya arşivlenmiş parafşn blok (doku) üzerinde yapılabilir; yeni teşhis konan hastalar için, platin direncine ilerleme sürecinde Elahere'nin kendileri için bir seçenek olup olmayacağını belirlemek için teşhis sırasında test yapılabilir.
Over Kanserinin Önemi ve Yeni Tedavi İhtiyacı
Over kanseri, 2020 Türkiye Kanser İstatistikleri’ne göre, yıllık 4059 yeni vaka ile en sık gözüken 15. Kanserdir. Erken evrelerde belirti vermemesi ve etkili bir tarama yönteminin olmaması sebebi ile hastaların çoğu ileri (3., 4.) evre kanser olduktan sonra başvurur ve temel tedavisi ameliyat ve ardından platin bazlı kemoterapidir. Ne yazık ki, hastaların çoğunluğu sonunda tedavisi zor olan platine dirençli hastalık geliştirir. Platin-bazlı kemoterapiye direnç geliştikten sonra standart tedavi tek ajanlı kemoterapilerdir, fakat bu, düşük yanıt oranları, kısa yanıt süreleri ve önemli yan etkilerle ilişkilidir. Platine dirençli yumurtalık kanseri, tedavisi zor bir hastalıktır. 2014'ten beri bu durumdaki hastalar için FDA tarafından onaylanan yeni tedaviler olmadığı göz önüne alındığında, Elahere'nin hızlandırılmış onayı, yumurtalık kanseri tedavi için muazzam bir gelişmedir. Platin-bazlı kemoterapiye duyarlı hastalar içinse PARP inhibitörleri sınıfınan yeni nesil ilaçlar, önemli katkılar sağlamıştı.
Elahere (mirvetuximab soravtansine-gynx) Etki Mekanizması Nasıldır?
ELAHERE (mirvetuximab soravtansine-gynx), bir folat reseptörü alfa bağlayıcı antikor, bölünebilir bağlayıcı ve hedeflenen kanser hücrelerini öldürmek için tasarlanmış güçlü bir tübülin inhibitörü olan maytansinoid DM4 kemoterapisi içeren, kendi sınıfının ilki olan bir antikor-ilaç konjugatıdır.
Elahere'nin bu hızlandırılmış onayı, yeni nesil antikor-ilaç konjugatlarını geliştirmeye adanmış onlarca yıllık çalışmaların bir kanıtıdır. Önümüzdeki süreçte çok daha fazla antikor-ilaç konjugatlarının kanser tedavisi için onay alacağını duyacağız.
Antikor–İlaç Konjugatı Nedir?
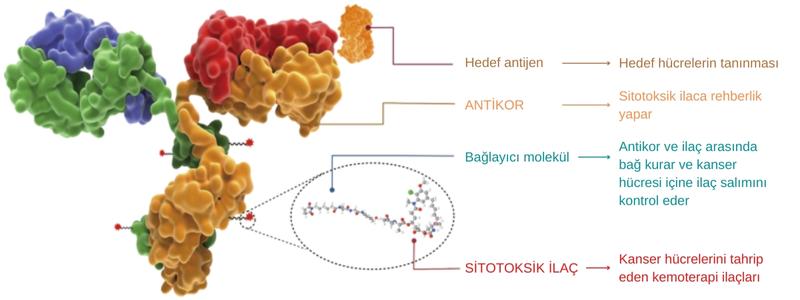
Antikor–ilaç konjugatları, tümördeki moleküler hedefi bağlayacak şekilde geliştirilen bir antikorun, kemoterapi ajanına eklendiği ve bunun belli bir tümör hücresine iletilmesine izin verdiği "Truva atı" yaklaşımını kullanır.
Aşağıda, antikor-ilaç konjugatlarının genel yapısı resmedilmiştir. Hedef antijenler, çoğunlukla kanserli hücrelerin yüzeyinde bulunur. Böylelikle antikor kanserli hücreye bağlanır ve daha sonra sitotoksik (hücre öldürücü) ilacı salar.
Elahere’ye FDA Onayı Getiren SORAYA Çalışması
Elahere, SORAYA adlı çalışmadan elde edilen objektif yanıt oranı ve yanıt süresi verilerine dayalı olarak FDA'nın hızlandırılmış onay programı kapsamında onaylandı. Bu hızlandırılmış onayın, tam bir onaya dönüşmesi, takip eden bir çalışmada klinik yararın doğrulanması ve tanımlanmasına bağlı olabilir.
Elahere’nin etkinliği, platine dirençli yumurtalık kanseri olan ve tümörleri yüksek düzeyde FRa ifade eden ve daha önce bir ila üç sistemik tedavi rejimi ile tedavi edilmiş 106 hastada tek kollu bir çalışma olan pivot SORAYA çalışmasında değerlendirildi. Çalışmanın birincil sonlanım noktası, araştırmacı tarafından değerlendirildiği şekliyle objektif yanıt oranı ve anahtar ikincil sonlanım nokta, yanıt süresi idi.
Sonuçlar
- Mirvetuximab soravtansine, beş tam yanıt dahil olmak üzere %31,7 objektif yanıt oranı gösterdi (%95 güven aralığı [GA]: 22,9, 41,6).
- Ortanca yanıt süresi 6,9 aydı (%95 GA: 5,6, 9,7).
Yan Etkiler
Elahere için reçeteleme bilgileri, görme bozukluğu, keratopati, kuru göz, fotofobi, göz ağrısı ve üveit dahil olmak üzere oküler toksisite için kutulu bir uyarı içerir. Laboratuvar anormallikleri de dahil olmak üzere en yaygın (hastaların %20'sinden fazla veya buna eşit) yan etkiler görme bozukluğu, yorgunluk, aspartat aminotransferazda artış, mide bulantısı, artmış alanin aminotransferaz, keratopati, karın ağrısı, azalmış lenfositler, periferik nöropati, ishal, azalmış albümin, kabızlık, artmış alkalin fosfataz, kuru göz, azalmış magnezyum, azalmış lökositler, azalmış nötrofiller ve azalmış hemoglobin.
Doz
Önerilen mirvetuximab soravtansine-gynx dozu, hastalık ilerlemesine veya kabul edilemez yan etkiye kadar intravenöz infüzyon olarak her üç haftada bir (21 günlük döngü) uygulanan 6 mg/kg’dir.
Bu hızlandırılmış onayı tam onaya dönüştürmek için tasarlanmış doğrulayıcı randomize çalışma olan MIRASOL’ün en önemli verilerinin 2023'ün başlarında çıkması beklenmektedir.
FDA grants accelerated approval to mirvetuximab soravtansine-gynx for FRα positive, platinum-resistant epithelial ovarian, fallopian tube, or peritoneal cancer. fda.gov 14 Nov 2022






