
Dacomitinib, 4. Evre Küçük Hücre Dışı Akciğer Kanseri Tedavisi İçin FDA Onayı Aldı
27 Eylül 2018'de, ABD Gıda ve İlaç Dairesi (FDA), epidermal büyüme faktörü reseptörü ( EGFR ) ekzon 19 delesyon veya ekzon 21 L858R mutasyonları yönünden pozitif, 4. evre, küçük hücreli olmayan akciğer kanseri (NSCLC) hastalarının ilk basamak tedavisi için dacomitinib tabletleri (Vizimpro) onayladı.
Dacomitinibe FDA Onayı Getiren ARCHER 1050 Klinik Araştırması
Onay, ameliat edilemez, metastatik, EFGR pozitif, küçük hücreli 452 hastada dacomitinib ile EGFR'yi hedef alan bir diğer akıllı ilaç olan gefitinibin (Iressa) karşılaştırıldığı randomize, çok merkezli, açık etiketli, aktif kontrollü ARCHER 1050 adlı klinik araştırmaya dayanmaktadır. Hastalar, daha önce metastatik veya tekrarlayan akciğer kanseri için tedavi edilmemişti ve EGFR ekzon 19 silinmesi veya ekzon 21 L858R ikame mutasyonları yönünden pozitifti.
Hastalar, kanserin progresyonu (ilerleyişi) veya kabul edilemez toksisiteye (yan etki) kadar günde bir kez oral yoldan (ağızdan) 45 mg dacomitinib veya günde bir kez 250 mg gefitinib almak üzere rastgele iki kola ayrıldı.
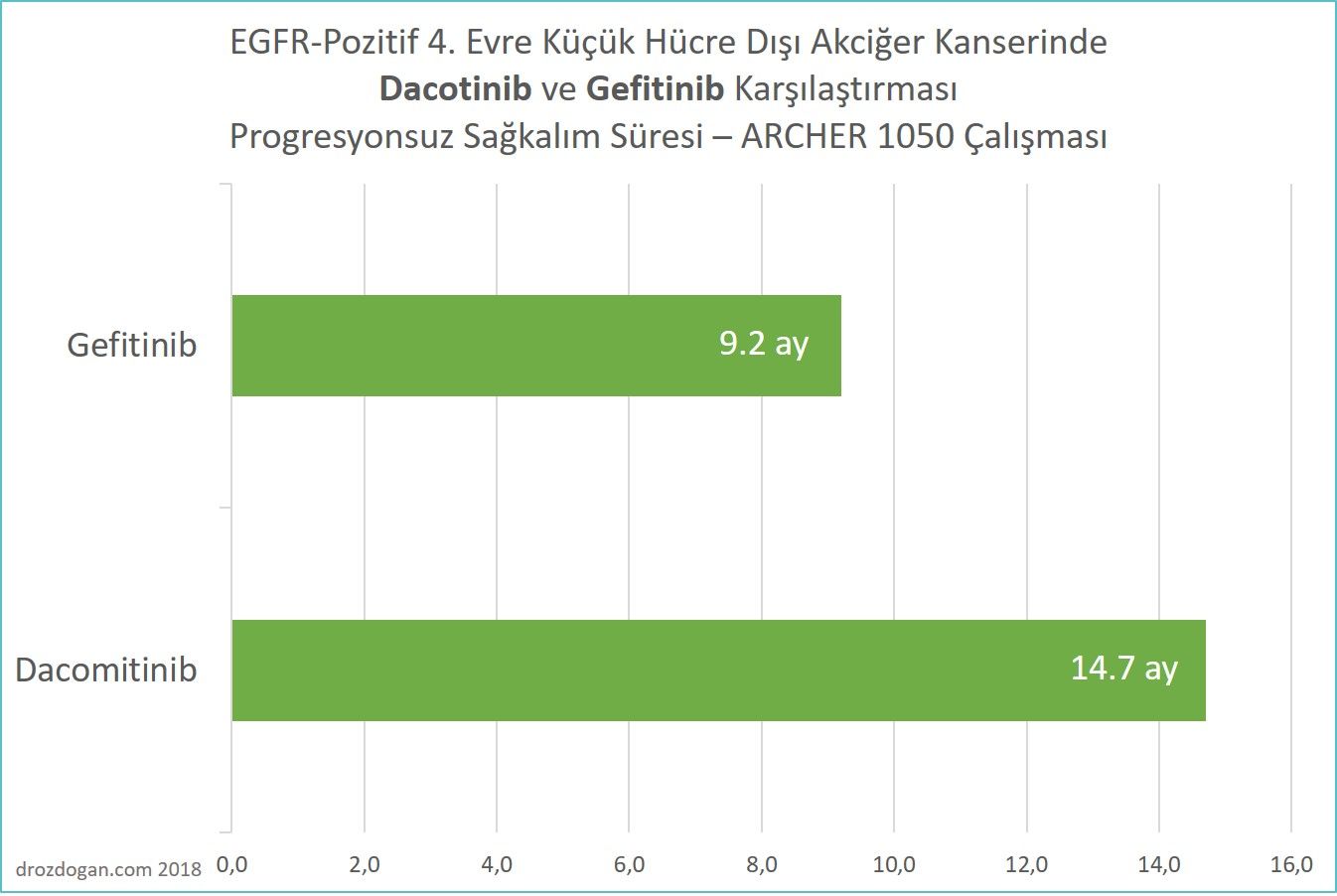
Bu klinik araştırma sonucunda, progresyonsuz sağkalım (tedavi ile kanseri kontrol altında tutma) süresinde belirgin bir fark dacomitinib lehine gözlendi; genel yanıt oranında veya genel sağkalımda anlamlı bir fark gözlenmedi.
Bağımsız bir gözden geçirme komitesi tarafından belirlendiği üzere, dacomitinib alanlarda progresyonsuz sağkalım süresi 14.7 ay iken, gefitinib alanlarda bu süre 9.2 ay bulundu ve dacomitinib, kanserin ilerleme riskini %41 azalttı.
Dacomitinip prospektüsünde interstisyel akciğer hastalığı (akciğerde inflamasyon, fibrozis ve yapısal bozulmayla giden bir hastalık grubu), ishal ve dermatolojik yan etkiler uyarılar bulunmaktadır. Dacomitinib alan 394 hastada bildirilen ciddi (3. ve 4. derece) yan etkilerin oranı % 27 oldu. Dacomitinib kesilmesine neden olan en yaygın yan etkiler ishal ve interstisyel akciğer hastalığı idi. Dacomitinibe bağlı en sık (>% 20) yan etkiler ishal, döküntü, paronişi (tırnak dolamsı), stomatit (ağız yarası), iştah azalması, kuru cilt, kilo kaybı, alopesi (saç dökülmesi), öksürük ve kaşıntı idi.
Önerilen dacomitinib dozu, günde bir kez aç olarak ağızdan 45 mg'dır.
FDA approves dacomitinib for metastatic non-small cell lung cancer.
fda.gov - 27 September 2018






