
Delta virüsü neden bu kadar tehlikeli? Koronavirüs hücreleri nasıl enfekte ediyor?
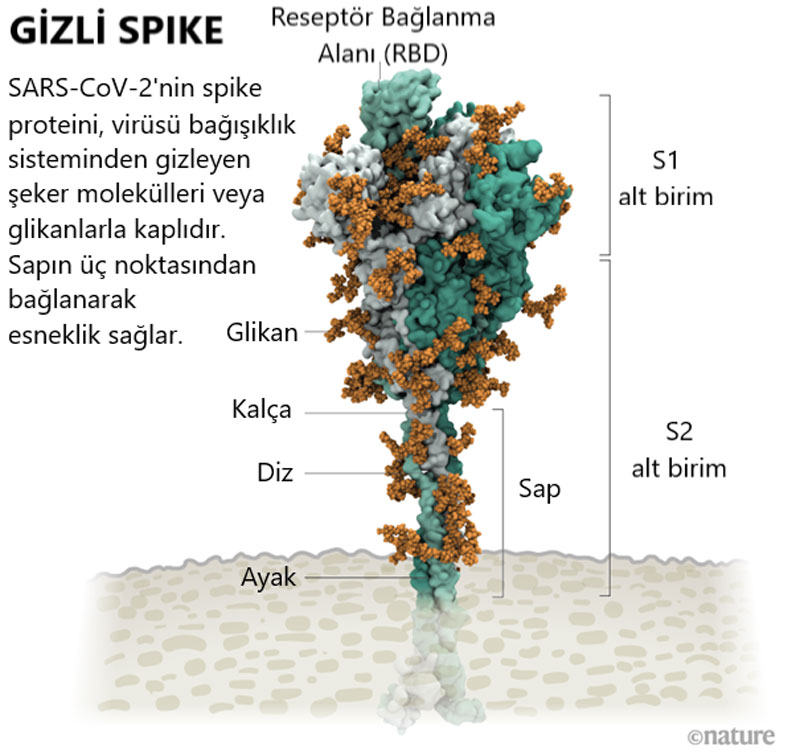
Koyun postu giymiş kurt misali birçok virüs, insan bağışıklık sistemine karşı kamufle olmak için dış proteinlerini kaplayan glikanlara sahiptir. San Diego California Üniversitesi’nden hesaplamalı biyofiziksel kimyager Rommie Amaro ve ekip arkadaşları, yapısal ve genetik verilere dayanarak virüsü kaplayan bu kılıfın şimdiye kadarki en ayrıntılı görselleştirmesini yaptı. Ekip bir süper bilgisayar yardımı ile görseli bir bir atom olacak şekilde tasarladı.
22 Mart 2020 tarihinde Twitter’da yayınladıkları simülasyona, bir saat için bir araştırmacı tarafından yorum geldi: Proteinin tepesinden çıkan çıplak, kaplanmamış halka nedir?
Amaro’nun bu soru için verecek bir yanıtı yoktu. Ancak yorumdan 10 dk sonra Austin, Texas Üniversitesi’nden Yapısal Biyolog Jason McLellan bu soruya cevaben bir yorum yaptı: Kaplanmamış halka, insan hücreleri üzerindeki reseptörlere bağlanan spike'ın (diken) üç bölümünden biri olan bir reseptör bağlanma alanı (RBD= receptor binding domain).
Görselin kaynağı: Structural image from Lorenzo Casalino, Univ. California, San Diego; Graphic: Nik Spencer/Nature
Amaro’nun simülasyonunda RBD, glikan bulutunun üzerinden yükselir ve iki glikan onu yerine bağlamak için tutarlar, tıpkı bir bisikletteki destek ayağı gibi. Amaro bilgisayar modelindeki glikanları mutasyona uğrattığında ise RBD çökmüştür. McLellan ve ekibi, aynı deneyi laboratuvarda denemek için bir yol geliştirdi ve 2020 Haziran ayına kadar, iki glikanın mutasyona uğratılmasının spike proteinin bir insan hücre reseptörüne bağlanma yeteneğini azalttığını bildirdiler. McLellan, bunun koronavirüslerde daha önce kimsenin bilmediği bir rol olduğunu söylüyor. Henüz araştırmacıların iki şekeri azaltmasına yönelik bir yol olmasa da Amaro, bunu başarmanın, virüsün bulaşıcılığını azaltabileceğini öne sürüyor.
Covid-19 pandemisinin başlangıcından bu yana bilim insanları, SARS-CoV-2’nin hücreleri nasıl enfekte ettiğine dair ayrıntılı bir kavrama geliştiriyorlar. Enfeksiyon süreci dışında, gelişmiş tedaviler ve aşılar ile durdurmanın daha iyi yollarını bulmak ve Delta gibi yeni varyantların neden daha bulaşıcı olduğunu öğrenmek istiyorlar.
Koronavirüs hücreleri nasıl enfekte ediyor?
Uzun yıllardır süregelen koronavirüs çalışmalarından alınan destek ile yürütülen 19 aylık çalışmadan ortaya çıkan şey, SARS-CoV-2'nin insan hücrelerini nasıl istila ettiğinin ayrıntılı bir açıklaması olmuştur. Bilim insanları, virüsün şaşırtıcı bir güçle insan hücrelerine tutunmasına ve ardından içeride gizlenmesine yardımcı olan önemli adaptasyonları ortaya çıkardı. SARS-CoV-2 daha sonra hücrelerden çıkarken, insan hücrelerini daha çok enfekte etmesi için parçacıklarını hazırlamak adına oldukça önemli bir işlem sürdürüyor. Bunlar, virüsün bu kadar hızlı yayılmasını ve milyonlarca can almasına sebep olan araçlardan bazılarıdır. Londra, Imperial College’dan Virolog Wendy Barclay bu durum için, "Kontrol edilmesi bu yüzden çok zor." diyor.
Görselin kaynağı: Hui (Ann) Liu, Univ. Utah; Graphic: Nik Spencer/Nature
Dikenli ve enfekte etmeye hazır
Her SARS-CoV-2 virionunun (virüs parçası), insan hücreleriyle birleşmesi için anahtar olan 24 – 40 tane rastgele düzenlenmiş spike proteinlerle dolu bir dış yüzeyi vardır. Grip gibi diğer virüs türleri için birleşme proteinleri nispeten serttir. Ancak, SARS-CoV-2 spikeları, Almanya Frankfurt Mac Planck Biyofizik Enstitüsü’nden Martin Beck ve arkadaşları tarafından 2020 Ağustos ayında yayınlanan çalışmaya göre inanılmaz derecede esnek ve üç noktadan bağlıdır.
Bu, spikeların dönmesine, sallanmasına ve çevrilmesine izin verir, bu da hücre yüzeyini taramalarını ve birden fazla spike’ın bir insan hücresine bağlanmasını kolaylaştırır. Beck, diğer koronavirüsler için benzer deneysel verilerin olmadığını ancak "spike protein dizileri yüksek oranda evrimsel olarak korunduğu için, karakterin paylaşıldığını" varsaymanın makul olacağını dile getirdi.
Görselin kaynağı: SARS-CoV-2'nin kiro-elektron tomografi görüntüleri (Scale bar: 30 nanometres.) Credit: B. Turoňová et al./Science
Pandeminin başlarında araştırmacılar, SARS-CoV-2 spike proteinlerinin RBD’lerinin, çoğu insan boğaz ve akciğer hücrelerinin zarında bulunan ACE2 reseptörü olarak adlandırılan tanıdık bir proteine bağlandığını onayladı. Bu reseptör aynı zamanda şiddetli akut solunum sendromuna (SARS) neden olan SARS-CoV virüsü için de bağlantı noktasıdır. Ancak SARS-CoV ile karşılaştırıldığında, yeni koronavirüs (SARS-CoV-2), ACE2 reseptörüne 2-4 kat daha kuvvetli bir şekilde bağlanır, çünkü RBD’deki birçok değişiklik, virüsün bağlanma noktalarını stabilize eder.
Varyantlar sorunu
SARS-CoV-2’nin endişe verici varyantları, RBD’leri barındıran ve ACE2 reseptörüne bağlanmadan sorumlu olan spike proteininin S1 alt birimde mutasyona sahip olma eğilimi gösterirler. (İkinci bir spike alt birim olan S2 de konakçı hücrenin viral füzyonu harekete geçirir.)
Örneğin Alfa varyantı, spike protein dizisinde 10 tane değişiklik içerir ve bu da RBD’lerin “yukarı” konumda kalma olasılıklarının daha yüksek olmasına neden olur. Kuzey Carolina Duke İnsan Aşı Enstitüsü’nde spike mutasyonları üzerinde çalışan Yapısal Biyolog Priyamvada Acharya, “Hücrelere girmeyi kolaylaştırarak virüsün ilerlemesine yardımcı oluyor” dedi.
Şu anda dünyaya yayılan Delta varyantı, üçü RBD’de olmak üzere S1 alt biriminde birçok mutasyona sahip ve bu mutasyonlar da Delta varyantının RBD’nin ACE2’ye daha güçlü bağlanma ve bağışıklık sisteminden kaçma yeteneğini geliştiriyor olduğu görünmektedir.
Kısıtlı giriş
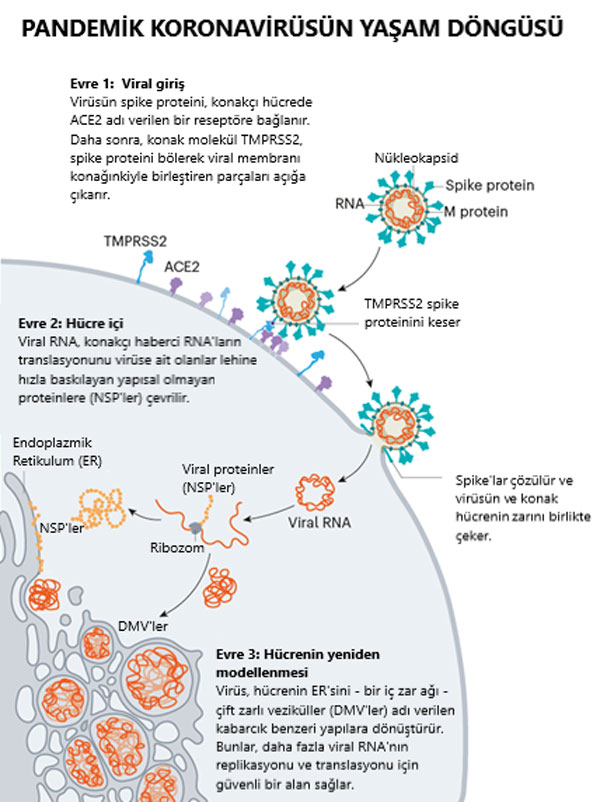
Virüsün dikenleri ACE2’ye bağlandığında, konak hücrenin yüzeyindeki diğer proteinler, viral ve hücre zarlarının birleşmesine yol açan süreç başlatırlar. (Şekil-4: Viral giriş)
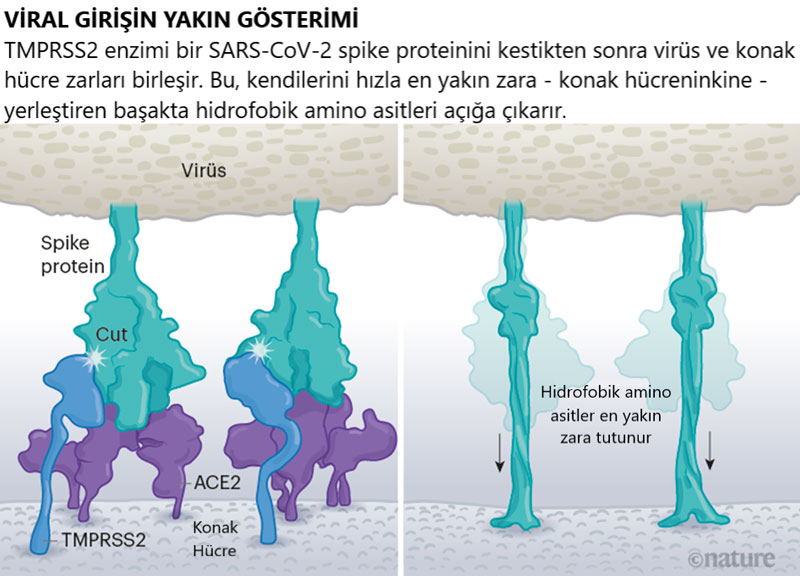
Kaynak: Janet Iwasa, Univ. Utah; Graphic: Nik Spencer/Nature
SARS’a neden olan virüs SARS-CoV, hücre içine girmek için iki konakçı proteaz enziminden birini kullanır: TMPRSS2 (tempress two) veya katepsin. TMPRSS2, hücre içine girmenin daha hızlı bir yoludur ancak SARS-CoV bunun yerine genellikle katepsin L’ye dayanan bir endozom – lipitle çevrili bir kabarcık – yoluyla girer. Virionlar ancak bu yoldan hücrelere girdiğinde, antiviral proteinler onları yakalayabilirler.
SARS-CoV-2, solunum hücrelerinin dışlarında yüksek miktarlarda bulunan bir enzim olan TMPRSS2’yi verimli bir şekilde kullandığı için SARS-CoV’dan farklıdır. İlk olarak, TMPRSS2, spike’ın S2 alt birimindeki bir bölgeyi keser. Bu kesilmiş bölge kendisini en yakın zara – yani konak hücreninkine – hızla gömen bir dizi hidrofobik aminoasit açığa çıkarır. Daha sonra, uzayan spike, bir fermuar gibi kendi üzerine katlanır ve viral ve hücre zarlarını birleşmeye zorlar.
Aşağıda, SARS-CoV-2'nin hücrelerle kaynaşmasının bir animasyonu. Credit: Janet Iwasa, University of Utah
Virüs daha sonra, genomunu doğrudan hücreye aktarır. Barclay ve Imperial College’daki meslektaşları tarafından Nisan ayında yayımlanan çalışmaya göre, SARS-CoV-2 bu şekilde istila ederek SARS-CoV’dan daha hızlı bulaşıyor ve endozomlarda yakalanmaktan kaçabiliyor.
Sıtma ilacı Plaquenil'in neden işe yaramadığının cevabı
Virüsün TMPRSS2’yi kullanarak hızlı bir şekilde giriş yapması, sıtma ilacı klorokinin, laboratuvarda erken umut verici sonuçlarına rağmen Covid-19 tedavisi olarak klinik deneylerde neden işe yaramadığını açıklar. Bunların, endozomal giriş için yalnızca katepsinlere dayanan hücreleri kullandıkları açığa çıktı. Barclay, “Virüs insan solunum yolunda bulaşıp ve çoğaldığında, endozom kullanmaz. Bu nedenle endozomal bozucu bir ilaç olan klorokin gerçek hayatta etkili değildir” şeklinde bir açıklama yapıyor.
Bulgu ayrıca, bir virüsün konakçı hücrelere girmek için TMPRSS2, katepsin L veya diğer proteazları kullanmasını önlemek için umut verici bir terapötik seçenek olarak proteazları da işaret etmektedir. Japonya’da pankreatit tedavi için onaylanan TMPRSS2 inbitörü “camostat mesilat”, akciğer hücrelerine viral girişi engellemiş ancak ilk klinik deneylerde hastaların sonuçlarında bir iyileşme olmamıştır.
ACE2 bağlanması ve TMPRRS2 yolağı üzerindeki araştırmalara öncülük eden Göttingen Alman Primat Merkezi’nden Enfeksiyon Biyolojisi Birim Başkanı Stefan Pöhlmann, “Benim bakış açıma göre, yeni hastalık salgınlarıyla savaşmak ve gelecekteki pandemileri en başından önlemek için geniş antiviraller gibi proteaz inhibitörlerine sahip olmalıyız” diyor.
Ölümcül rekabet
Enfeksiyonun sonraki adımları daha da karanlıktır. Viral yaşam döngüsünün açıklamalı bir animasyonunu yapan, Utah Üniversitesi’nden Kimyager Janet Iwasa “Hücreye girişten sonra çok daha fazla kara kutu vardır. Daha fazla belirsizlik ve rakip hipotez vardır” diyor.
Koronavirüsler hücresel makineleri birçok yönden ele geçiriyor. Virolog Noam Stern-Ginossar ve ekibi, SARS-CoV-2’nin konak mRNA’sının çevresini kendi lehine olacak şekilde bastırmasının üç mekanizmasına odaklandı. Stern-Ginossar, "Hiçbiri bu virüse özel değil, ancak etkilerin kombinasyonu, hızı ve büyüklüğü benzersiz kılıyor" diyor.
- İlk olarak, virüs rekabeti ortadan kaldırır: Virüs insan hücresine girmek istediğinde, translasyonu tamamlanan ilk protein olan Nsp1, viral etiketi olmayan tüm hücresel mRNA’ları sistemik olarak parçalamak için konak proteinleri ele geçirir. Ancak Stern-Ginossar’ın ekibi, aynı etiketi bir konakçı mRNA’nın ucuna koyduğunda, mRNA’nın parçalanmadığını görmüştür.
- İkinci olarak, enfeksiyon, hücredeki genel protein translasyonunu %70 oranında azaltır. İki farklı araştırma ekibinin çalışmalarına göre Nsp1, yine baş suçludur. Bu sefer fiziksel olarak ribozomların giriş kanalını bloke eder ve böylece mRNA ribozoma giremez. Stern-Ginossar, kalan küçük translasyon kapasitesinin viral RNA’lara ayrıldığını söylüyor.
- Son olarak ise virüs, hücrenin alarm sistemini kapatır. Bu çeşitli şekillerde gerçekleşir ancak Stern-Ginossar’ın ekibi SARS-CoV-2 için net bir mekanizma tanımlamıştır: Virüs, bağışıklık sistemini enfeksiyona karşı uyarması amaçlanan proteinler için talimatlar da dahil olmak üzere hücresel mRNA’nın çekirdekten çıkmasını engelliyor. İkinci bir ekip ise bu bulguyu doğrulamıştır ve tekrar Nsp1’i işaret etmiştir: protein, çekirdekteki çıkış kanallarını sıkıştırıyor gibi görünüyor, böylece hiçbir şey kaçamıyor. Gen transkriptleri çekirdekten dışarı çıkmadığı için, enfekte hücreler çoğu interferonları salgılamazlar – interferonlar, bağışıklık sistemini bir virüsün varlığına karşı uyaran sinyal proteinleridir. SARS-CoV-2, bu alarm sistemini kapatmada özellikle etkilidir: SARS-CoV ve solunum sinsisyal virüsü (RSV) dahil olmak üzere diğer solunum yolu virüsleriyle karşılaştırıldığında, SARS-CoV-2 enfeksiyonu önemli ölçüde daha düşük interferon seviyelerine neden olur. 2021 Haziran ayında araştırmacılar, Alfa varyantında interferon üretimini daha da verimli bir şekilde bastırmaya sebep olan mutasyonlar bildirmiştir.
Stern-Ginossar, “SARS-CoV-2’nin, bağışıklık sistemimizin enfeksiyonu tanımasını ve ilk aşamalarda enfeksiyonla mücadele etmesini önleme konusunda benzersiz bir yeteneğe sahip çok hızlı bir virüs olduğu açıktır.” diyor. Bağışıklık sistemi, bir virüs olduğunu fark ettiğinde o kadar çok virüs vardır ki, bağışıklık yanıtı proteinleri bazen kan dolaşımına normalden daha hızlı bir şekilde geçer – ki bu da zararlı olabilir. Pandeminin başlarında, Covid-19 hastalığı çok şiddetli geçiren kişilerin, virüsün yanı sıra SARS-CoV-2’ye karşı aşırı aktif bir bağışıklık tepkisinden zarar gördüğü anlaşılmıştı. Bazı kanıtlanmış tedaviler, bu bağışıklık tepkisini azaltacak şekilde etkilidir.
Yenileme istasyonu
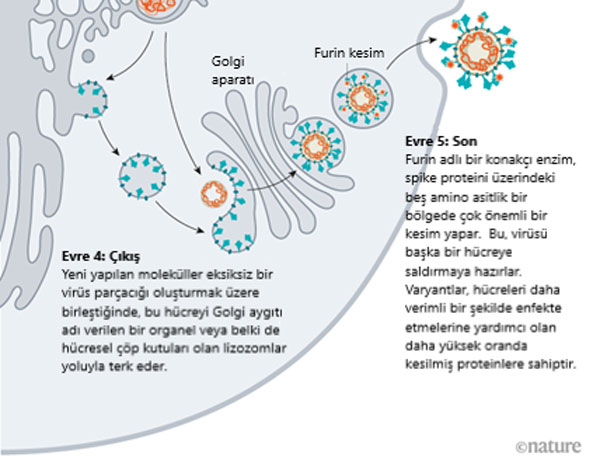
Virüs, konak translasyonunda aldığı hücrenin içini ve dışını ihtiyaçlarına göre kapsamlı bir şekilde şekillendirerek değişikliklere başlar.
İlk olarak, yeni yapılmış viral spike proteinlerin bazıları hücrenin yüzeyine gider ve konak hücre zarından dışarı çıkarlar. Orada, hücrenin dışına yağlı bir kılıf yapacak olan bir konakçı kalsiyum iyon kanalını aktive ederler – aynı kılıf, kas hücreleri gibi doğal olarak birleşen hücrelerde de bulunur. Bu noktada enfekte olmuş hücre, 20’ye kadar çekirdekle dolu büyük bireysel solunum hücrelerine dönüşerek, ACE2 eksprese eden komşu hücreler ile birleşir.
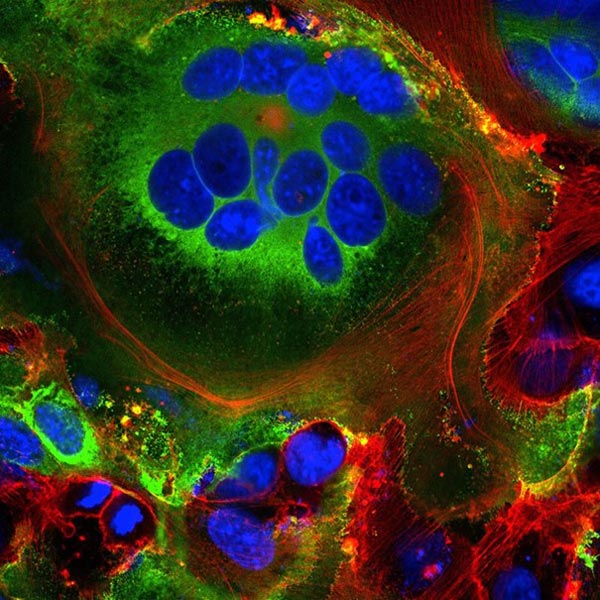
SARS-CoV-2 spike proteinini (yeşil) ifade eden hücrelerde görülen kaynaşmış hücre yapıları (syncytia). Çekirdekler mavidir ve hücre iskeleti kırmızıdır. Credit: Mauro Giacca
18 Nisanda, Londra King’s College’dan Moleküler Biyolog Mauro Giacca ve ekibi yeni bir bulgu yayımladı: Sinsisya adı verilen bu birleşmiş yapılar, HIV ve herpes simpleks virüsü gibi viral enfeksiyonlar tarafından indüklenir, ancak SARS virüsü tarafından indüklenmez. Giacca, Sinsisya oluşturmanın, enfekte olmuş hücrelerin uzun süre gelişmesine izin verdiğini ve giderek daha fazla virion yaydığını varsayıyor. “Bu bir vur-kaç virüsü değil, devam ediyor” diyor. Pekin Çin Tıp Bilimleri Akademisi’nden araştırmacı Qiang Sun ve ekibi ise, Covid-19 ile enfekte olmuş bazı hücrelerin lenfositler ile – vücudun kendi bağışıklık hücrelerinden biri – Sinsisya oluşturduğunu buldular. Bu, tümör hücreleri tarafından bilinen bir bağışıklıktan kaçma mekanizmasıdır, virüsler için değil. Enfekte olmuş hücrelerin, yakındaki bağışıklık izcilerine tutunarak ve onlarla birleşerek bağışıklık tespitinden kaçındığını öne sürülüyor.
DMV’lerin yapımında yer alan proteinler, viral replikasyon için görüldüklerinden iyi bir ilaç hedefi olabilirler. Örneğin, ER zarlarını genişletmek için kolesterol ve diğer lipidleri harekete geçirmek için bir konakçı protein olan TMEM41B'ye ihtiyaç duyulur, böylece tüm virüs parçaları içine sığar. Araştırmaya katılan Galveston, Texas Tıp Şubesi'nden bir koronavirüs araştırmacısı Vineet Menachery, "TMEM41B'yi çıkardığınızda enfeksiyon üzerinde büyük bir etkisi vardır" diyor. Koronavirüs transmembran proteini Nsp3 de bir hedef olabilir: yeni yapılmış viral RNA'yı dışarı atmak için DMV'lerin duvarlarında taç benzeri bir gözenek oluşturmaktadır.
Zarf olarak bilinen bir dış kılıfa sahip çoğu virüs, bu özelliği, hücrenin doğrudan kenarında toplanarak ve çıkış yolunda hücrenin kendi plazma zarının bir kısmını seçerek oluşturur. Ancak yeni yapılan koronavirüs proteinleri farklı bir yol izlemektedir.
Yıllardır, koronavirüslerin hücre dışına, postacı gibi çalışan, molekülleri zarlardan paketleyen ve onları hücrenin diğer bölümlerine gönderen bir organel olan Golgi kompleksi aracılığıyla taşındığı ileri sürülmüştür. Orada virüs, Golgi kompleksinin zarından bir lipit zarf oluşturur; Maryland, Johns Hopkins Üniversitesi'nde 30 yıldır koronavirüsler üzerinde çalışan Virolog ve Hücre Biyologu Carolyn Machamer, yeni oluşan virionların daha sonra Golgi veziküllerinin içinde hücre yüzeyine bırakıldıkları yer olan hücre yüzeyine taşındığını söylüyor.
Ancak Aralık ayında, Maryland, Bethesda ABD Ulusal Kalp, Akciğer ve Kan Enstitüsü'nden Hücre Biyoloğu Nihal Altan-Bonnet ve arkadaşları, hücreyi lizozomlar – hücre parçalarını parçalayan enzimlerle dolu hücresel çöp kutuları – yoluyla terk eden koronavirüsleri tespit ettiklerini bildirdiler. Altan-Bonnet, Golgi tabanlı salgı yolunun bloke edilmesinin, salınan bulaşıcı virüs miktarını etkilemediğini söylüyor. Ekibin elde ettiği kanıtlar, viral proteinlerin ER'ye tomurcuklanarak bir zarf oluşturduğunu ve ardından hücreden çıkmak için lizozomları devraldığını gösteriyor. Araştırmacılar şu anda potansiyel antiviral adaylar olarak lizozomal çıkış sürecini bloke eden inhibitörleri test ediyorlar.
Bir hücreyi Golgi veya lizozomlardan terk etmek, bir plazma zarından tomurcuklanmaya kıyasla yavaş ve verimsizdir, bu nedenle bilim insanları SARS-CoV-2'nin bunu neden yaptığını bilmiyorlar. Machamer, Golgi'den veya lizozomdan türetilen bir zarfın lipit bileşiminin virüs için plazma zarındakinden bir şekilde daha faydalı olduğundan şüpheleniyor. "Bu kısmı biraz daha iyi anlasaydık, yeni antiviral terapötikler için büyük fırsatlar olurdu" diyor.
Son
Hücreden çıkarken, bir olay daha bu virüsü bulaşıcı yapar: Beş amino asitlik bir bölgede hızlı bir kesim, virüsü bir sonraki hedefine saldırmak için hazırlar.
Diğer koronavirüslerin spikelarındaki S1 ve S2 alt birimlerinin birleşme noktasında tek bir arginin amino asidine sahip olduğu durumlarda, SARS-CoV-2 beş amino asitlik bir diziye sahiptir: prolin, arginin, arginin, alanin ve arginin. Pöhlmann, "Bölge olağandışı olduğu için buna odaklandık ve evet, bölgenin akciğer hücrelerinin istilası için gerekli olduğu ortaya çıktı" dedi. Mayıs 2020'de arkadaşları ile birlikte, furin adı verilen bir konakçı hücre proteininin, bu amino asit dizisini tanıdığını ve kırptığını – ve virüsün insan akciğer hücrelerine verimli bir şekilde girmesi için kesmenin "gerekli" olduğunu bildirdi.
Araştırmacıların bir virüs üzerinde bir furin bölünme bölgesi tespit etmesi ilk değildir; Barclay, son derece patojenik kuş gribi virüslerinde de buna sahip olduğunu söylüyor. Bir arkadaşı Barclay'e kültürde furin bölünme bölgesini kendiliğinden kaybetmiş bir SARS-CoV-2 suşu gönderdiğinde, ekibi, bu suşla enfekte olan yaban gelinciğinin, pandemik suşla enfekte olanlardan daha düşük miktarlarda viral partiküller saçtığını ve enfeksiyonu yakınındaki hayvanlara bulaştırmadığını buldu. Barclay'in ekibi Eylül 2020 ön baskısında sonuçlarını bildirirken, Hollanda'da yapılan bir araştırma da sağlam bir furin bölünme bölgesi olan koronavirüsün insan hava yolu hücrelerine, bu bölgesi olmayanlara göre daha hızlı girdiğini bulundu.
Furin'in bölgeyi virion birleştirme sırasında veya serbest bırakılmadan hemen önce kestiğinden şüpheleniliyor. Chicago, Loyola Üniversitesi’nden Virolog Tom Gallagher, zamanlamanın virüsün neden Golgi veya lizozomlardan çıktığını açıklayabileceğini söylüyor. "Virüs bir kez toplandığında, furin proteaz varlığında yıkanabileceği bir organele girer."
Gallagher, Furin kesimi, S1 ve S2 alt birimleri arasındaki bağı kopararak, virion spike proteinlerini gevşetir, böylece hücre girişi sırasında, kendisini bir konakçı hücre zarına hızla gömen hidrofobik alanı açığa çıkaran TMPRSS2 tarafından ikinci bir kesime yanıt verirler, diyor. Spikelar, furin tarafından önceden kesilmezse – her zaman değil – TMPRSS2'yi atlarlar ve varsa daha yavaş endozomal yoldan girerler.
İki koronavirüs varyantı, Alpha ve Delta, Furin bölünme bölgelerini değiştirmiştir. Alfa varyantında, ilk prolin amino asidi bir histidine (P681H) değiştirilir; Delta varyantında, bir arginin (P681R) olarak değiştirilir. Barclay, her iki değişikliğin de diziyi daha az asidik hale getirdiğini ve amino asit dizisi ne kadar bazik olursa, furin onu o kadar etkili bir şekilde tanır ve keser, diyor. “Bunu, virüs bulaşmada daha da etkili hale geldi olarak varsayabiliriz.”
Daha fazla furin kesimi, insan hücrelerine girmeye hazırlanan daha fazla spike proteini anlamına gelir. Menachery ve ekibi hazır olan spike proteinlerini saydıklarını çalışmayı henüz yayımlamamış olsalar da Menachery, SARS-CoV'de, spike proteinlerin %10'dan daha azı hazır olduğunu söylüyor. SARS-CoV-2’de ise bu oran %50’ye çıkıyor. Alfa varyantında da %50'den fazladır. Ekip, son derece bulaşıcı Delta varyantında, spikeların %75'inden fazlasının bir insan hücresini enfekte etmek için hazır olduğu buldu.
Bilinen bilinmeyenler
Bilim topluluğu hala SARS-CoV-2 anlayışının henüz yüzeyini eşeliyor. MacLellan önemli bilinmeyenler arasında şunları sayıyor; her bir spike proteine bağlanmak için gereken ACE2 reseptörlerinin sayısı, tam olarak S2 bölgesi TMPRSS2 tarafından bölündüğünde ve virüs-hücre zarı füzyonu için gereken spike sayısı – ve bunlar sadece virüsün hücreye girişi için olan bilgiler. Nisan 2020'de San Francisco California Üniversitesi'nden bir ekip, SARS-CoV-2 ile insan proteinleri arasında en az 332 etkileşim tespit etti.
Hızla mutasyona uğrayan virüse ayak uydurmak kolay değil. Uzmanlar, şimdiye kadarki çoğu mutasyonun, virüsün konakçıya ne kadar zarar verdiğiyle değil, virüsün ne kadar etkili yayıldığıyla ilişkili olduğu konusunda hemfikir. Bu ay yapılan bir araştırma, Delta varyantının, virüsün önceki versiyonlarından daha hızlı ve insanların akciğerlerinde ve boğazlarında daha yüksek seviyelerde ürediğini bildirdi.
Ancak Stern-Ginossar, Delta mutasyonlarının, varyantı bu şekilde nasıl güçlendirdiğinin henüz net olmadığını söylüyor. "Bu, birçok laboratuvarın anlamaya çalıştığı bir şey."
İLGİLİ KONULAR
How the coronavirus infects cells — and why Delta is so dangerous
Scientists are unpicking the life cycle of SARS-CoV-2 and how the virus uses tricks to evade detection. Nature News. 28 July 2021. Megan Scudellari






