Enzalutamid (Xtandi) FDA Onay Geçmişi
- FDA onaylı: Evet (ilk onay tarihi 31 Ağustos 2012)
- Etken madde adı: enzalutamid
- Kutu adı: Xtandi (orjinal molekül)
- Uygulama şekli: Yumuşak kapsül
- Sınıfı: Anti-androjen
- Kategori: Hormonal ajan
- Üretici: Astellas (orijinal molekül)
- Türkiye dağıtımı: Astellas İlaç
- Onaylı olduğu kanser: Prostat kanseri
Enzalutamid etken maddeli Xtandi adlı ilaç, prostat kanseri olan hastaların tedavisi için kullanılan bir androjen reseptör inhibitörüdür.
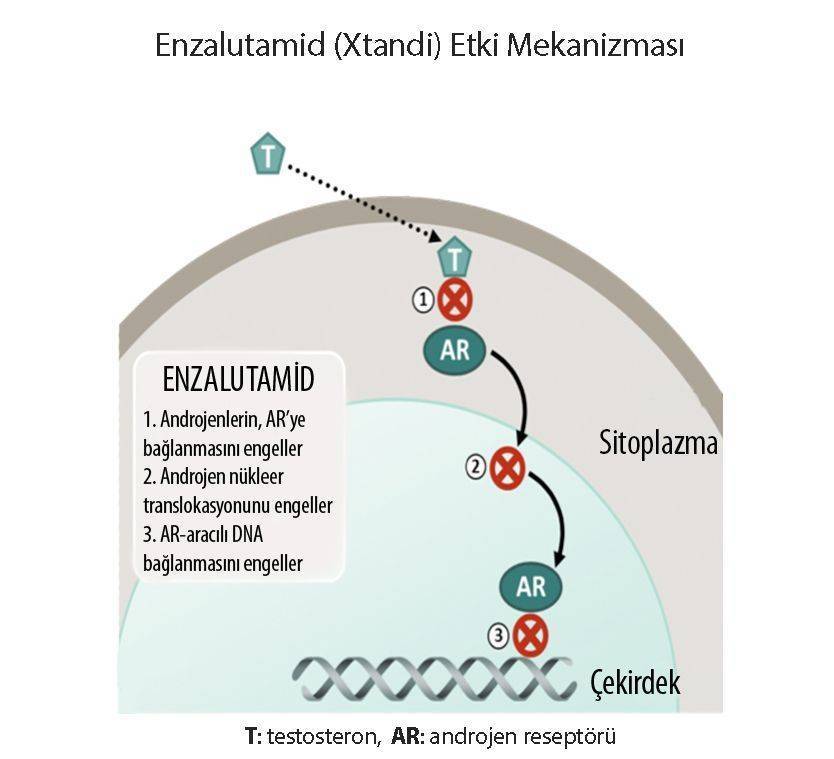
Etki Mekanizması
- Androjen reseptörü sinyal yolundaki farklı basamaklarda etki gösteren saf androjen reseptörü (AR) antagonisti.
- AR'lere androjen bağlanmasını rekabetçi bir şekilde ve AR nükleer translokasyonunu ve ligand-reseptör kompleksinin ko-aktivatör alımını inhibe ederek inhibe eder.
- Reseptörde ve reseptör sonrası ligand bağlanma seviyesinde androjen-AR yolunu inhibe eder.
- N-desmetil enzalutamid metaboliti, enzalutamide benzer antitümör aktivite sergiler.
Xtandi için FDA Onay Tarihçesi
- 16 Aralık 2019: FDA Xtandi'yi (enzalutamid) Metastatik Kastrasyona Duyarlı Prostat Kanserinin Tedavisi İçin Onayladı
- 13 Temmuz 2018: FDA, Metastatik Olmayan Kastrasyona Dirençli Prostat Kanseri Olan Erkeklerin Tedavisi için Xtandi'yi Onayladı
- 31 Ağu 2012: FDA Xtandi'yi Geç Evre Kastrasyona Dirençli Prostat Kanseri İçin Onayladı
Xtandi için Türkiye Ruhsatı
Xtandi, ilk olarak 26.04.2016 tarihinde T.C. Sağlık Bakanlığı ruhsatı almıştır.
Ülkemizde ruhsatlı olduğu durumlar / terapötik endikasyonlar şu şekilde belirtilmiştir:
- Xtandi visseral metastazı olmayan, metastatik, hormona duyarlı prostat kanserli (mHDPK) yetişkin erkeklerde androjen düşürme tedavisiyle kombinasyon tedavisinde endikedir.
- Enzalutamid, bazal PSA değeri 2ng/ml üzerinde olan ve PSA ikiye katlanma zamanı 6 aydan daha kısa olan, testosteron düzeyi 50ng/dl’nin altında olan, daha önce sitotoksik kemoterapi almamış olan, ECOG performans değeri 0 ve 1 olan, metastatik olmayan kastrasyon dirençli prostat kanseri hastalarının kullanımında endikedir.
- Xtandi’nin, hormonal tedaviyle ve sonrasında dosetaksel temelli kemoterapiyle progresyonun PSA ve radyolojik görüntüleme yöntemleriyle gösterildiği ve testosteron düzeyinin kastrasyon seviyesinde olduğu gösterilmiş olan, metastatik prostat kanserli hastalarda progresyona kadar kullanımı endikedir.
- Xtandi’nin kastrasyona dirençli progresyonun PSA ve görüntüleme yöntemleriyle gösterildiği ve testosteron düzeyi kastrasyon düzeyinde olan (˂50 ng/dl), kemoterapinin kontrendike, kemik iliği rezervi ileri derecede azalmış ve/veya diabetus mellitus tanısı olan metastatik prostat kanserli hastalarda progresyona kadar kullanımı endikedir.
Daha önce abirateron kullanmış hastalarda XTANDI kullanımı endike değildir. Kullanılmak istenmesi durumunda “Endikasyon Dışı Onay” başvurusunda bulunulmalıdır.
Xtandi Geri Ödemesi Var mı?
Xtandi, aşağıdaki endikasyon için Sosyal Güvenlik Kurumu (GSK) tarafından geri ödeme kapsamına alınmıştır.
- Metastatik Hormon Duyarlı Prostat Kanserli (mHDPK) Hastalar
- Viseral metastazı olmayan metastatik hormon duyarlı prostat kanserli (mHDPK) yetişkin erkeklerde androjen düşürme tedavisi ile progresyona kadar kullanılması halinde bedelleri kurumca karşılanır.
- Metastatik-olmayan Kastrasyona dirençli Prostat Kanserli (mo KDPK) Hastalar
- Bazal PSA değeri 2ng/ml üzerinde olan ve PSA ikiye katlanma zamanı 6 aydan daha kısa olan, testosteron düzeyi kastrasyon seviyesinde olan, daha önce sitotoksik kemoterapi almamış ve ECOG performans skoru 0-1 olan metastatik olmayan kastrasyona dirençli prostat kanserli hastalarda progresyona kadar kullanılması halinde bedelleri kurumca karşılanır.
- Metastatik Kastrasyona Dirençli (mKDPK) Hastalar
- Kastrasyona dirençli, progresyonun PSA ve görüntüleme yöntemleriyle gösterildiği ve testosteron düzeyi kastrasyon seviyesinde olan (50 ng/dl), kemoterapinin kontrendike olduğu veya diabetes mellitus tanısı olan metastatik prostat kanserli hastalarda progresyona kadar kullanılması halinde bedelleri kurumca karşılanır.
- Hormonal tedaviye ve sonrasında dosetaksel temelli kemoterapiye dirençli, ECOG performans skoru 0-1 olan, progresyonun PSA ve görüntüleme yöntemleriyle gösterildiği, metastatik prostat kanserli hastalarda kullanılması halinde bedelleri kurumca karşılanır.
Direnç Mekanizması
- Androjen reseptörü gen yeniden düzenlemesi, androjen reseptörünü ligand bağlama alanından yoksun olacak şekilde yapılsal olarak değiştirir.
- Dirence ayrıca androjen reseptörü ve ek varyantlarının aktivasyonu yoluyla NF-κB2/p52 aracılık edebilir.
- Androjen reseptörünün azalmış ifadesi.
- Enzalutamide bağlanma afinitesinin azalmasına yol açan androjen reseptöründe mutasyon.
Emilim
Oral uygulamayı takiben hızla emilir. Oral alımdan 0.5-3 saat sonra plazma seviyeleri doruk yapar. Günlük alımdan sonra 28. günde kararlı durum ilaç seviyeleri elde edilir. Gıda ile uygulama emilim derecesini değiştirmez.
Dağılım
Tek bir oral dozdan sonra ortalama görünür dağılım hacmi 110 L'dir (%29 CV). Başta albümin olmak üzere plazma proteinlerine kapsamlı bağlanma (%97-%98). N-desmetil enzalutamid metaboliti ayrıca plazma proteinlerine geniş ölçüde bağlanır (%95).
Metabolizma
Oral uygulamayı takiben başlıca metabolitler enzalutamid, N-desmetil enzalutamid ve inaktif bir karboksilik asit metabolitidir. CYP2C8 ve CYP3A4, ilaç metabolizmasından sorumlu ana karaciğer mikrozomal enzimleridir. CYP2C8, birincil olarak aktif metabolit N-dimetil enzalutamidin oluşumundan sorumludur. Öncelikle hepatik metabolizma ile elimine edilir. Enzalutamid için ortalama terminal yarılanma ömrü 5,8 gündür ve N-desmetil enzalutamid için ortalama terminal yarılanma ömrü 7,8 ila 8,6 gündür.
Doz Aralığı
Önerilen doz günde bir kez 160 mg PO'dur (4 adet 40 mg’lik kapsül). Ek steroid tedavisi olmadan kullanılabilir.
İlaç etkileşimleri
- Gemfibrozil gibi güçlü CYP2C8 inhibitörleri ile birlikte uygulama, hem enzalutamid hem de N-desmetil enzalutamidin plazma ilaç konsantrasyonlarını artırır.
- Güçlü veya orta dereceli CYP2C8 indükleyicileri (örn. rifampin) ile birlikte uygulama, enzalutamidin plazma maruziyetini değiştirebilir.
- Güçlü CYP3A4 inhibitörleri (örn. itrakonazol) ile birlikte uygulama, enzalutamid ve N-desmetil enzalutamidin plazma ilaç konsantrasyonunu artırabilir.
- Güçlü CYP3A4 indükleyicileri (örn. karbamazepin, fenobarbital, fenitoin, rifabutin, rifampin, rifapentin) ve orta CYP3A4 indükleyicileri (örn. bosentan, efavirenz, etravirin, modafinil, nafsilin ve St. John's Wort) ile birlikte uygulama plazma ilaç konsantrasyonunu azaltabilir enzalutamid.
Dikkat Edilmesi Gerekenler
- Hafif veya orta derecede böbrek yetmezliği olan hastalarda başlangıçta doz ayarlaması gerekli değildir. Şiddetli böbrek yetmezliği (Kreatinin klirensi <30 mL/dak) veya son dönem böbrek hastalığı olan hastalarda çalışılmamıştır.
- Hafif veya orta şiddette karaciğer yetmezliği olan hastalarda başlangıçta doz ayarlaması gerekli değildir. Şiddetli karaciğer yetmezliği (Child-Pugh Sınıf C) olan hastalar değerlendirilmemiştir.
- Hastaları epileptik nöbet aktivitesi açısından yakından izleyin. Hangi hastaların nöbet geliştirme riskinin arttığı açık değildir.
- Üreme potansiyeli olan kadın partnerleri olan erkek hastalar, tedavi sırasında ve ilacın son dozundan 3 ay sonra etkili kontrasepsiyon kullanmalıdır.
Yan Etki 1
Asteni (yorgunluk, güçsüzlük ve enerji eksikliği gibi fiziksel ve zihinsel yorgunluk belirtileri) ve yorgunluk hastaların %50'sinde görülür.
Yan Etki 2
Sırt ağrısı, artralji, kas-iskelet ağrısı, kas zayıflığı, kas-iskelet sertliği ve patolojik olmayan kemik kırıkları gibi kas-iskelet sistemi yan etkileri meydana gelir.
Yan Etki 3
İshal hastaların yaklaşık %20'sinde görülür ve genellikle hafiftir.
Yan Etki 4
Sıcak basmaları hastaların %20'sinde görülür.
İlgili konu: Erkek menopozu nedir? Kanser tedavisi sonrası erkeklerde menopoz belirtileri ve tedavisi
Yan Etki 5
Yan Etki 6
Nöbetler, hastaların <%1'inde nadiren görülür ve genellikle tedavinin kesilmesiyle düzelir.
Chu, Edward; DeVita Jr., Vincent T.. Physicians' Cancer Chemotherapy Drug Manual 2022. Jones & Bartlett Learning.






