Kanser hücresinin şaşırtıcı enerji metabolizması
Kanser hücreleri, sürekli olarak bölünüp çoğalabilen anormal hücrelerdir. Sınırsız proliferasyon (bölünme), transformasyon (başkalaşma) ve migrasyon (göç etme) yetenekleri ile karakterize olan bu hücreler, yine bu ihtiyaçlarını karşılamak için alışılmışın dışında farklı metabolik yolaklar ile kendileri için gerekli olan enerjiyi elde ederler. Birçok karsinojenik sinyal yolağının asıl amacı, 3 ana metabolik yolak olan glukoz, lipid ve amino asit metabolik yolaklarını kontrol etmektir.
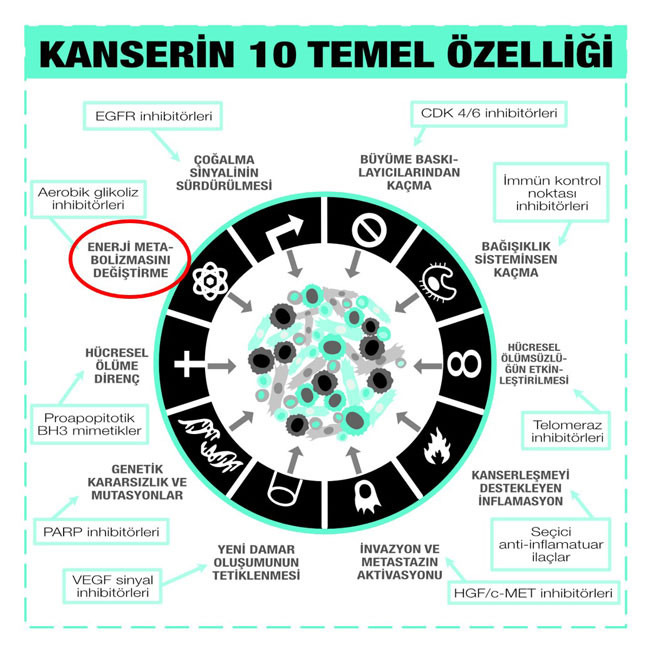
Şekil 1: Kanserin 10 Temel Özelliğinden biri de hücresel enerjiyi kendi lehine yeniden düzenlemesidir. Aşağıda, kanserin 10 Temel Özelliği ve her birine karşı geliştirilen kanser ilaç çeşitleri görülebilir:
Kanser metabolizmasını anlamak için 4 kritik kavram
Warburg etkisi
1931 Nobel Fizyoloji veya Tıp Ödüllü bilim insanı Otto Heinrich Warburg tarafından ilk defa ortaya atılan Warburg etkisi, tümör hücrelerinin normal hücreler gibi glikolizisi takip eden sitrik asit döngüsü ve oksidatif fosforilasyon (aerobik solunum) yerine laktik asit fermantasyonunu seçmesidir. Anaerobik (oksijensiz) solunum olarak da adlandırlan bu durumun, enerji üretimi için çok daha verimsiz olmasına karşın, tümör hücrelerinde hücre çoğalmasına destek olan yan metabolitlerin üretimi ve yüksek aktivitede hücreye zarar verebilecek serbest oksijen radikalleri üretiminin önüne geçmek gibi faydaları vardır.
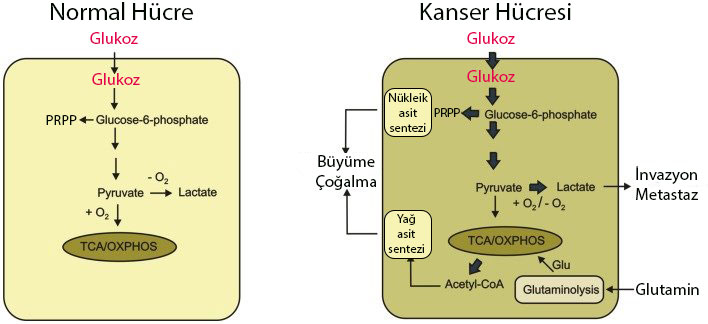
Şekil 2: Kanser hücreleri glikozu yoğun olarak pentoz fosfat yolağında ve laktik asit fermantasyonunda kullanırlar. Yani glikozu basitçe işleyerek, fazla oksijene ihtiyaç duymadan düşük miktarda ATP (enerji) üretirler. Kanser hücreleri glikozu, aşağıda bahsedilecek olan Krebs döngüsüne sokmama eğilimindedir. Buna karşın, kandan daha fazla glikoz çekme kabiliyetine sahiptir. Kanser hücrelerinin glikozu pentoz fosfat yolağına yönlendirmesinin sebeplerinden biri, bu yolak ile pürin ve pirimidin nükleik asitlerini sentezlemesi için gerekli olan riboz şekerini üretmektir. Nükleik asit sentezi, sürekli olarak bölünen bu kanser hücreleri için olmazsa olmazdır. Bir diğer yolak olan laktik asit fermantasyonu ise farklı bir işleve sahiptir. Kanser hücreleri bu yolak ile ürettikleri laktik asiti intrasellüler aralığa salarak etrafındaki normal hücrelere zarar verirler ve böylece invazyon (etrafındaki dokuyu işgal) ve metastaz (uzaktaki dokuyu işgal) gibi fonksiyonlar kazanırlar. Ayrıca bu hücreler amino asitleri Krebs döngüsünde asetik KoA’ya dönüştürüp, asetil KoA’yı da hücre büyümesi ve bölünmesi için gerekli olan yağ asiti sentezinde kullanır.
Yeni araştırmalar tümör hücrelerinin bu etkiyi, 6-fosfofrukto-2-kinaz / fruktoz-2,6-bifosfataz 4 (PFKFB4) enziminin glikolizisi aktive ederek, steroid reseptör koaktivatörü-3 (SRC-3)’ün transkripsiyonel aktivitesini arttırarak ve glukozu pentoz fosfat yoluna yönlendirerek gerçekleştirdiğini açığa çıkardı. Bu tümör hücrelerinin niçin aktif bir mitokondri metabolizması göstermediğini açıklıyor. Tümör hücrelerinin yüksek glikoz tüketimi, bu metabolik yolağın tedavi vadeden klinik bir hedef haline gelmesini sağlıyor.
Kanser hücreleri birden fazla metabolik sinyal yolağına sahiptirler ki buna glikozu tekrardan aerobik solunama yönlendirip mikro çevrede oksidatif fosforilasyona devam etmek de dahildir. Kanser hücrelerinin metabolik yolaktaki yaptıkları düzenleyici değişiklikler Warburg etkisinin de ötesine uzanır. Klinikte müdahalelerde kullanılan maddeleri daha iyi anlamak için tümör metabolizmasını araştırmak elzemdir.
Krebs döngüsü
1953 Nobel Fizyoloji veya Tıp Ödüllü bilim insanı Hans Krebs tarafından keşfedilen Krebs döngüsü, diğer adı ile TCA siklusu, hücrelerimizin glikolizisin son ürünü olan piruvatı, mitokondri içinde NADH ve FADH2 oluşturmak için döngüden geçirmesidir. Tabiki hücrelerimiz bu yolakta sadece glukozu kullanmazlar. Yağ ve amino asitleri de yıkarak döngünün farklı basamaklarından dahil ederler. Üretilen bu NADH ve FADH2 molekülleri daha sonra elektron transport zincirinden geçirilerek ATP molekülleri üretilir ki biz buna oksidatif fosforilasyon adını veriyoruz.

İlk bakışta amacı sadece ATP üretmek gibi gözüken bu döngünün hücre metabolizmasında bir sürü farklı rolü vardır. Sitokrom C salınımı ile hücre ölümünü teşvik etmesi, mitokondrial DNA salınımı ile aktif immün yanıt oluşturulması, serbest oksijen radikalleri üreterek transkripsiyon faktörlerinin aktiflenmesi ve Krebs döngüsündeki ara metabolitler ile hücre sinyal yolaklarını kontrol etmek bu döngünün diğer görevlerindendir. Hal böyle olunca Krebs döngüsünün sadece enerji üretimi ile anılması düşünülemez.
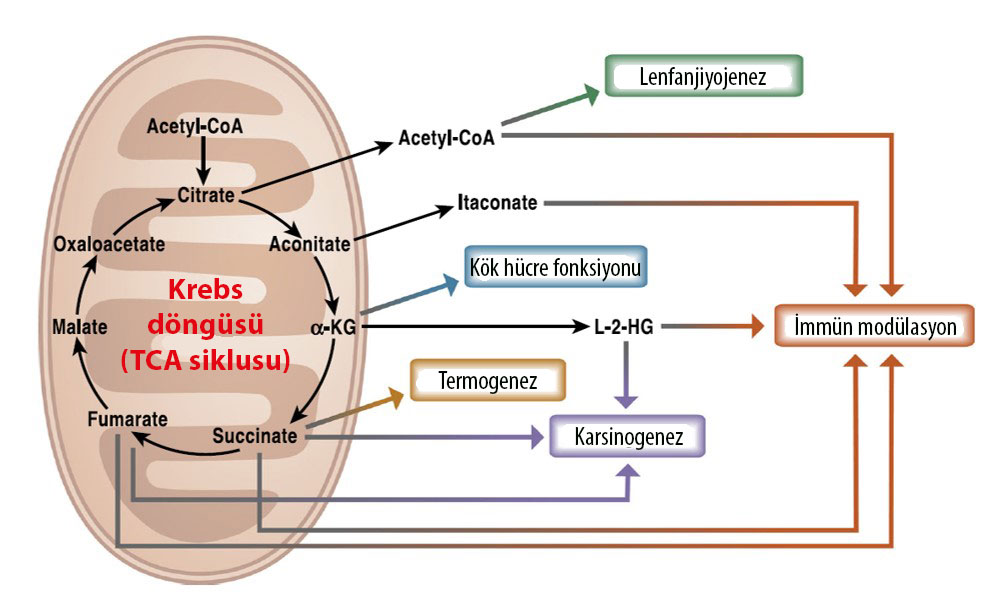
Şekil 3: Krebs döngüsü metabolitleri fizyoloji ve patolojide çok önemli ve birbirinden farklı etkilere sahiptir. Asetil KoA, itakonat, süksinat, fumarat ve L-2-hidroksi glutarat hem doğal bağışıklık sisteminin hem de edinilmiş bağışıklık sisteminin yanıtını değiştirebilir. Yeni lenf damarları oluşumu ve kök hücre pluripotensinin devam ettirilmesi gibi fonksiyonlar ise sırası ile asetil KoA ve α-ketoglutarat ile ilişkilidir. Süksinat, fumarat ve L-2-hidroksi glutarat tümör oluşumunu destekleyen tümör metabolitleri arasındadır. Ayrıca süksinat, soğuğa mağruziyette ısı üretimini regule etmede sistemik bir sinyal görevi görür.
Yukarıda da bahsettiğimiz üzere Warburg etkisi ile tümör hücreleri Krebs döngüsünden kaçma eğilimindedirler. Fakat bazı tümör türlerinde hücrelerin mikroçevrede bu döngüye devam ettiğini görüyoruz. Bunun sebebi Krebs metabolitlerini bölünme ve büyüme için gerekli olan sinyal yolaklarını aktive etmede kullanmalarından kaynaklanmaktadır.
Son araştırmalar diklorasetatın mitokondrial oksidasyonu stimüle edip Warburg etkisini azalttığını ve de tümör metabolizmasına müdahale ettiğini göstermiştir. Bu metabolik onkolojide tedavi vadeden bir gelişmedir.
Fosforilasyon
Fosforilasyon, kimyasal moleküllere fosfor grubu eklenilmesi olarak bilinen bir reaksiyondur. Organizma bu reaksiyonu molekülleri aktifleştirmek veya susturmak için kullanır. Normal hücre metabolizmasında aktif olarak kullanılan fosforilasyon, kanser metabolizmasında da önemli role sahiptir. Rahim ağzı kanser hücrelerinde yapılan in vitro deneyler fosforillenmiş glikoz-6-fosfat dehidrogenaz (G6PD)’ın pentaz fosfat yolağını aktif tuttuğunu ve makro moleküllerin sentezini devam ettirdiğini göstermiştir. Meme kanserinde AMP ile aktive olan protein kinazın (AMPK) PFKFB4’ü fosforlayarak aktif ettiği ve hücreyi oksidatif solunum yerine glikozise yönlendirdiği görülmüştür.
Hipoksi
Tümör hücreleri ortamda oksijenin varlığına bakmadan glikozu anaerobik yolak olan laktik asit fermantasyonuna yönlendirirler. Warburg etkisi adı altında bunu zaten yukarıda bahsetmiştik. Fakat hipoksik (oksijenin ortamda az bulunduğu) koşullarda bazı enzimler bu etkiyi arttırır. Hipoksi ile indüklenen faktör 1α (HIF-1α) olarak bilinen transkripsiyon faktörü ile glukoz tranporter 1 (GLUT-1), piruvat dehidrogenaz kinaz 1 (PDK-1) ve laktat dehidrogenaz A (LDHA) gibi moleküllerin sentezi artar. GLUT-1 hücre içine glikoz girişinde görev yapar ve hücre bu sayede artan glikoz ihtiyacını karşılamaya çalışır. LDHA enzimi glikozu laktata dönüştürürken, PDK-1 enzimi piruvat dehidrogenaz (PDH) enzimini inhibe eder. PDH enzimi piruvatı asetil KoA’ya dönüştürüp Krebs döngüsüne katılmasını sağlayan enzimdir. Sonuç olarak hipokside salınan bu HIF-1α ile tümör hücreleri Warburg Etkisini güçlendirir.
2019 Nobel Tıp Ödülü, hücrelerin oksijen varlığını nasıl hissettikleri ve hipoksiye (oksijen azlığına) nasıl adapte olduklarına dair çalışmalara verilmişti. Tümörlerin de hızlı bir şekilde büyümeleri için, hipoksiye adapte olacak hücresel mekanizmaları iyi bir şekilde kullanmaları gerekir. İşte bu fikirle, tümör hücrelerinin hipoksiye adapte olma mekanizlarını hedef alan ilaçların kanser tedavisinde etkili olabileceği fikri doğdu ve bu konuda ilaç geliştirme çalışmaları başladı.
Yeni, sınıfında bir ilk olan küçük molekül, hipoksi indüklenebilir faktör 2 alfa (HIF-2α) inhibitörü, metastatik (4. evre) berrak hücreli böbrek kanseri olan ve daha öce çoklu basamak tedavi almış hastalarda tek ajan olarak anlamlı anti-kanser aktivite gösterdi. Bu HIF2A inhibitörünün faz I / II çalışmasından elde edilen sonuçlar, 2020 Genitoüriner Kanserler Sempozyumu'nda tarafından sunuldu.

Sonuç
Kanser metabolizması araştırmaları geçtiğimiz yıllarda büyük gelişmeler yaşadı. Fakat bu mekanizmalar ve arkasında yatan genetik sebebler hala ileri araştırmalara ihtiyaç duyuyorlar. Kanserin metabolizmayı yeniden programlaması üzerine yeni keşifler, ileride tedavi yöntemlerine dönüşecek metabolik zayıflıkları aydınlatabilir. Hep beraber bilimin gelecekte neler getireceğini göreceğiz.
ÖNERİLEN OKUMALAR
1. Zhenye Tang, Zhenhua Xu, Xiao Zhu, Jinfang Zhang. New insights into molecules and pathways of cancer metabolism and therapeutic implications. Cancer Communications 10 November 2020.
2. Cancer Hallmarks - Reprogramming Energy Metabolism. https://steemit.com/research/@cristi/cancer-hallmarks-reprogramming-energy-metabolism