Kanserin tedaviye DİRENÇ geliştirmesi nedir? Çözüm arayışları nelerdir?
Günümüzde 4.evre (metastatik) kanserlerde kemoterapi ve hormon tedavilerinin yanına hedefe yönelik akıllı ilaçlar ve immünoterapiler eklenmiştir. Metastatik kanserlerde artık bölgesel tedaviler olan ameliyat ve radyoterapi dışında çok sayı ve çeşitte sistemik tedavi seçenekleri mevcuttur.
Kanser tedavilerinde her geçen gün başarılı sonuçlar alınmaktadır. Yeni nesil ilaçların geliştirilmesi, cerrahide yenilikler ve aynı zamanda genetik biliminin de katkılarıyla daha etkili ve hastaya özgü tedaviler tasarlanması hastaların yaşam sürelerini belirgin ölçüde uzatmıştır. Tüm bu çabalara rağmen, hastaların bir kısmında karşılaşılan en önemli problem, tedavinin işe yaramaması veya tedaviye yanıt vermedi şeklinde ifade edilen ilaca karşı dirençtir. Tedaviye direnç durumu kanser ilaçlarından sadece kemoterapi ve hormonal tedavide değil, hedefe yönelik ilaçlar ve immünoterapide de gözükmektedir.
Hedefe yönelik kanser tedavileri (genel olarak monoklonal antikorlar veya küçük moleküllü ilaçlar), tümör büyümesi ve ilerlemesi için gerekli olan belli moleküllere müdahale etmek için tasarlanmış ilaçlardır. Geleneksel sitotoksik (hücre öldürücü) kemoterapiler genellikle hücre bölünmesine müdahale ederek vücuttaki bölünen hücreleri hızla öldürür. Hedefe yönelik tedavilerin birincil amacı, kanser hücreleriyle daha hassas ve potansiyel olarak daha az yan etki ile savaşmaktır.
Hedefe yönelik tedavinin bazı dezavantajları vardır:
- Hücresel düzeyde bazı hedeflenen moleküller için ilaç geliştirmek zordur. Bunun sebepleri, hedefin yapısı, hedefin hücredeki işlevi veya her ikisidir.
- Kanser hücreleri stres altında kendilerini koruyacak mekanizmaları aktif etmeleriyle genetik yapılarını değiştirebilir ve hedefe yönelik tedaviye dirençli hale gelebilir. Bu nedenle, diğer hedefe yönelik tedavi türleriyle veya kemoterapi ve radyasyon gibi diğer kanser tedavileriyle kombine olarak kullanıldıklarında en iyi sonucu verebilirler.
Kanserde iki tip ilaç dirençliliği görülür:
1. Birincil (primer) ilaç dirençliliği: Tedavi öncesi birtakım faktörlerin etkisiyle meydana gelmektedir. Bu durumda genetik ve epigenetik faktörlerin etkisinin olduğu düşünülmektedir.
2. Kazanılmış / edinsel (acquired) ilaç dirençliliği: Tedavi süresince veya tedavi sonrasında meydana gelmektedir. Kanser hücresinin “genetik” yapısı stabil değildir, bu nedenle hızla mutasyon geçirir. Tedavinin başlangıcında ilaca karşı yanıt görülür ancak daha sonra direnç gelişmektedir.
Kanserde ilaç direnç mekanizmaları yoğun araştırılan bir konudur ve ilaç dirençliliğine yol açan birçok mekanizma vardır:
- Epigenetik
- İlacın inaktive edilmesi
- İlaç hedefini değiştirme
- Epitelyal mezenkimal geçiş
- Hücre ölümünün engellenmesi
- DNA hasar tamiri
- İlacı hücre dışına atma
Nature dergisinde yayımlanan “Kanserin Kilometre Taşları” (Nature Milestones Cancer) özel sayısında, kanserde ilaç dirençliliğine önemli bir yer verilmiştir. Aşağıda bu konuda detaylı bilgi yer almaktadır:
Kanserde direnç yolları nelerdir?
Milenyumun başında, seçici olarak kanserde rolü olan sürücü genleri hedef alan ilaçlar geliştirilmişti. Örneğin, imatinib gibi tirozin kinaz inhibitörlerinin, yapısal tirozin kinaz aktivitesine sahip bir füzyon geni olan BCR-ABL'yi hedefleyerek, ileri evre kronik miyeloid lösemili (KML) hastalarda sürekli ve kalıcı remisyona yol açtığı gösterilmiştir.
Not: Bir tirozin kinaz inhibitörü, tirozin kinazlar adlı enzim grubunu inhibe eden sentetik bir ilaçtır. Tirozin kinazlar, sinyal iletim yolakları ile birçok proteinin aktivasyonundan sorumlu enzimlerdir.
Daha geleneksel genotoksik tedavilerin (örneğin kemoterapiler) aksine, bu ilaçların daha az yan etkiye neden olduğuna inanılıyordu. Böylesine hassas hedefe yönelik tedavilerle, bu yeni nesil ilacın hastalar ve doktorlar tarafından uzun süredir aranan “sihirli değneği / tedaviyi” temsil edebileceğine dair umutlar yüksekti.
Ne yazık ki gerçek o kadar basit değil
Hastalar (ileri evrelerde veya karmaşık moleküler değişikliklere sahip olanlar bile) başlangıçta bu hedeflenen ilaçlara yanıt verse de Druker ve arkadaşları tarafından bildirilen imatinib ile yapılan bir klinik çalışmada akut lenfoblastik lösemili hastalarda veya lenfoid blast krizinde KML'si olan hastalarda, tümörlerin birkaç hafta veya ay boyunca süren günlük tedaviden sonra kanser tekrarı yaşadığını gösterdi. Kanser hücrelerinin, temel kanser mekanizmasını doğrudan hedef alan özel stratejilere nasıl adapte olabildiği sorusu hala tartışılmakta ve araştırılmaktadır.
Mercedes E. Gorre, Charles Sawyers ve arkadaşları bu soruyu yanıtlamak için yola çıktılar. Imatinibin BCR-ABL kinaz alanını bağlayarak çalıştığı ve böylece işlevini bloke ettiği bilinmektedir. Chin ve arkadaşlarının önceki çalışması, kanserlerin genellikle birincil onkogenlerinin (bir çeşit kanser-genleri) aktivitesini gerektirdiğini gösterdiğinden, Gorre ve arkadaşları, imatinibe dirençli tümörlerin hala BCR-ABL füzyon genine bağımlı olup olmayacağını merak etti. Nükseden tümörlerin hala BCR-ABL'ye bağımlı olması durumunda, BCR-ABL sinyal aktivitesinin tedaviden sonra bile belirgin olacağı sonucuna vardılar. BCR-ABL proteininin hızlı bozunması nedeniyle, aşağı akış hedeflerinden biri olan CRKL'nin fosforilasyonunu ölçtüler. Aslında, relapsı olan 11 hastadan alınan tümörlerde, CRKL fosforilasyonu neredeyse tedavi edilmeyen hastalardaki kadar yüksekti.
Uyarıcı (büyüme faktörü) olmadan uyarılma
Bir sonraki adım, BCR-ABL'nin aktif kalmasına neyin izin verdiğini belirlemekti. Yazarlar, bir hücre içi faktörün sorumlu olduğu sonucuna varmışlardır, çünkü hastalardan izole edilen nükseden hücreler hala bu onkojenik aktiviteyi göstermektedir, dolayısıyla hiçbir dış büyüme faktörünün dahil olmadığını düşündürmektedir. Yazarlar, BCR-ABL genindeki değişiklikleri incelediler ve farklı hastalarda çarpıcı biçimde farklı iki kaçış mekanizması buldular.
Dirençle ilişkili ilk değişiklik, inhibitörle savaşmak için bir kaba kuvvet olarak topyekün yaklaşım olarak anlaşılabilir: Nükseden üç hastanın tümörleri, gen amplifikasyonu (çoğalması) yoluyla BCR-ABL geninin birçok kopyasını üretmişti. Sonraki tedavi basamakları ile kopya sayısı arttı; ancak bir hastada bu amplifikasyonlar başka bir tedaviye geçtikten sonra ortadan kayboldu, bu da ilacın amplifikasyonu taşıyan klonlar için seçildiğini düşündürdü.
İlaçtan kaçış mutasyonları
Buna karşılık, ikinci direnç mekanizması tek bir modifikasyon gerektirdi: altı hastada ABL1'in treonin 315'ini izolösin'e değiştiren bir nokta mutasyonu bulundu. Bu belirli amino asit, imatinib bağlanması için kritik olduğundan, mutasyon ilaca bağlanmayı iptal etti. Yabanıl tip (doğal fenotip) BCR-ABL'nin aksine, bu mutant, ilaca maruz kaldıktan sonra bile hücre çizgilerindeki aktivitesini korumuştur.
Kanserin evrimi
Bu çalışma, Kobayashi ve arkadaşlarının akciğer kanserinde gefitinibe direnç kazandıran EGFR mutasyonlarının keşfi de dahil olmak üzere kısa bir süre sonra yayınlanan benzer çalışmalarla birlikte, kanserin birkaç önemli yönünü göstermektedir. Bir yandan, bu veriler kanserin evrimsel bir süreç olduğunu gösteriyor: güçlü seçici baskı altında, olumsuz ortamın üstesinden gelmelerine izin veren adaptasyonlu hücreler hâkim olacak.
- İlgili konu: Kanserin evrimleşmesi nedir? (detaylı)
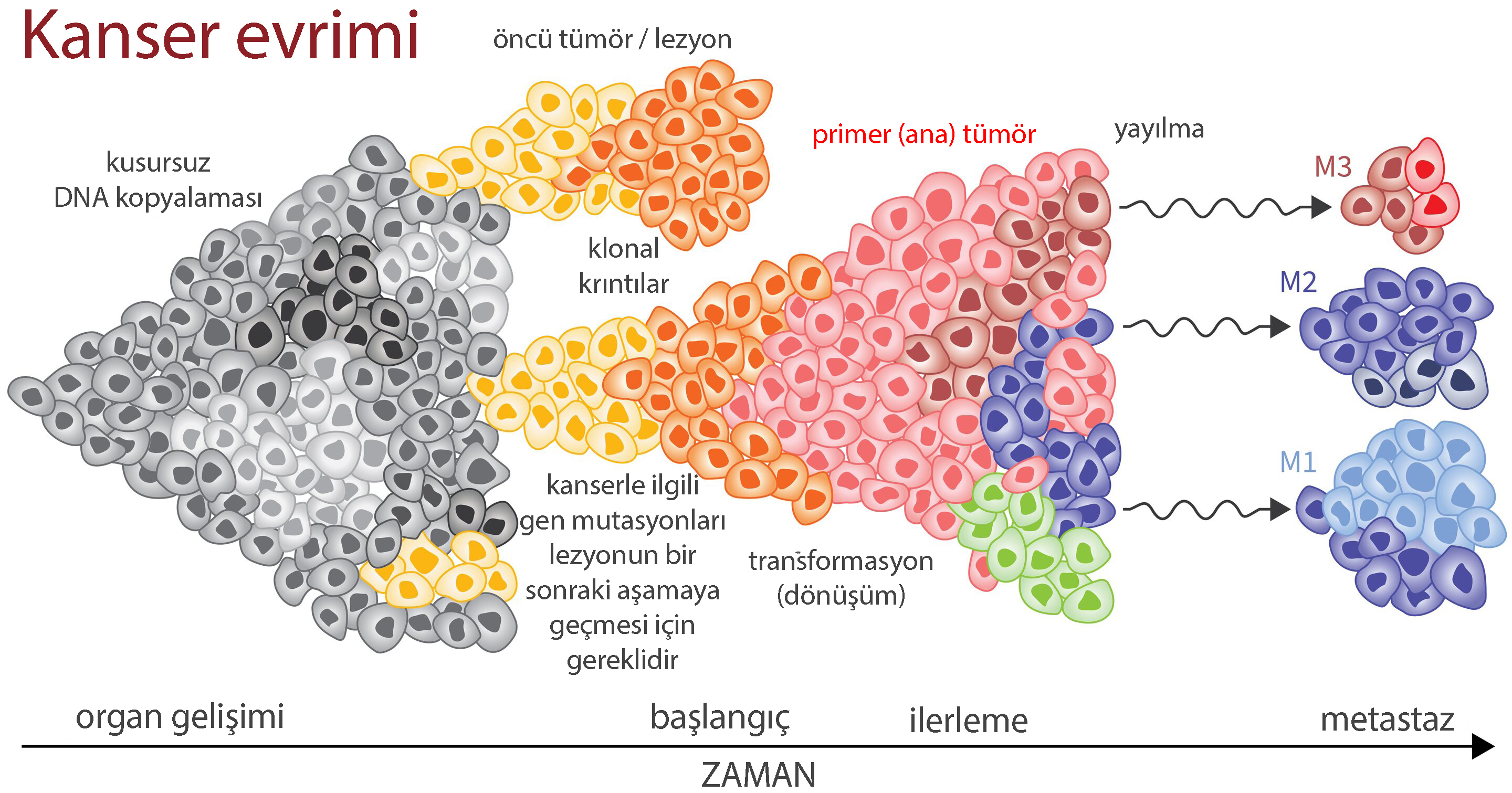
Tedaviye dirençli hücreler ilk tümörde de olabilir mi?
Bu tür hücreler aslında ilk tümörde zaten mevcut olabilir. Görünüşte homojen kanserler bile, Dagogo-Jack ve Shaw tarafından tanımlandığı gibi, terapiye karşı 'silahlanma yarışında' üstünlüğü olan genetik olarak heterojen (karma) hücre gruplarını barındırabilir. Ek olarak, direnç, belirgin bir şekilde farklı ancak işlevsel olarak yakınsak yaklaşımlarla elde edilebilir. Öte yandan, bu çalışmalar kanserlerin kritik bir özelliğini de açığa çıkardı: belirli genler ve mutasyonlar, tümör büyümesi ve hayatta kalması için temel sürücüler / tetikleyiciler olmaya devam ediyor.
Çözüm adımları
İlaç dirençliliğinde merkezi itici güçleri bilmek ve hedeflemek, klinik olarak etkili tirozin kinaz inhibitörlerinin yeni nesillerini geliştirmek için kullanılan önemli bir klinik strateji olmaya devam etmektedir.
Hedefe yönelik tedaviler, özellikle tek bir ilaca karşı direnci önleyebilecek farklı kombinasyonlarda test edildiğinde, kanserlerle mücadelede cephaneliğin önemli bir parçası olmaya devam edecektir. Hedef dışı, genetik olmayan mekanizmaların bu dirençteki rolleri de kabul edilmeye başlanıyor ve buna uygun şekilde uyarlanmış yaklaşımlarla ele alınması gerekecek. Bu tedavi stratejilerin tasarımı ve kullanımı evrimsel ilkeler tarafından yönlendirildiği sürece, ümidimiz, hastalardaki ilaç direncinin bir gün tahmin edilip, dirençten kaçınılacağıdır.
Sonuç
Kemoterapi ve hormon tedavilerinin yanı sıra, hedefe yönelik tedaviler (monoklonal antikorlar ve küçük moleküllü ilaçlar) ve immünoterapiler, genetik biliminin de gelişmesiyle bugün kanserleri tedavi etmede önemli bir yere sahiptir. Kombine ilaç tedavileri, genetik ve genetik olmayan mekanizmalarla ilgili yapılan araştırmalar, bir gün ilaç direncininin aşılabileceğine dair umut vadetmektedir.
1. Ilse Valtierra, Nature Communications. Routes to resistance. Nature Milestones Cancer. 5 Dec 2020
2. Gorre, M. E. et al. Clinical resistance to STI-571 cancer therapy caused by BCR-ABL gene mutation or amplification. Science 293, 876–880 (2001).