Nobel ödüllü CRISPR gen düzenleme tekniği ile KALITSAL hastalıkların tedavisi
Genetik makas olarak adlandırılan ve 2020 Nobel Kimya Ödülü'nün konusu olan çok hassas ve pratik gen düzenleme tekniği CRISPR'daki gelişmeler, germline (kalıtsal) genetik hasarları düzeltme çağını başlatıyor.
Hızlı, doğru ve kullanımı kolay CRISPR-Cas9, genomik düzenlemeyi daha verimli hale getirdi; aynı zamanda insan germline (kalıtsal, sprem ve yumurta hücresi ile aktarılan) düzenlemesini de çok daha uygulanabilir hale getirdi. Ayrıca, hassas / noktasal düzenleme, genlerini düzenlemesini önlemek için oluşturulan etik engellerin ve kaygıların çoğunu azalttı.
San Diego, California Üniversitesi Uygulamalı Etik Enstitüsü'nün eş direktörü Dr. John H. Evans, "İnsan gen düzenlemesi olarak adlandırılan şey hakkındaki etik tartışma 50 yıldan fazla süredir devam ediyor" diye yazıyor. "Neredeyse tüm zaman boyunca, somatik ve insan germline düzenleme arasında ahlaki bir ayrım olduğu konusunda fikir birliği var."
Not: İnsanın gen haritasının çıkartılmasıyla birlikte yapılan araştırmalarda kanser oluşumuna neden olan hasarların ( mutasyonların ) çoğunun vücut yani somatik hücrelerde meydana geldiği bulunmuştur. Bu tür mutasyonlara somatik mutasyonlar denir. Yani, bu hasarlar kalıtım yoluyla yavru döllere geçmez. Ancak az da olsa üreme hücrelerinde meydana gelen mutasyonlar yavru döllere geçer ve kanser riskini artırıcı yönde etki yapar. Bu tür mutasyonlara germline / kalıtsal mutasyonlar denir.
Genetik hastalıklarda bilimden beklenti büyük – etik tartışmalar yumuşamalı
Proceedings of the National Academy of Sciences'da ( PNAS ) yayınlanan bir makalede Evans, bir zamanlar germline düzenlemeyi ayrıntılı bir kavram haline getiren güçlü biyoetik argümanların çoğunun CRISPR çağında çözülmeye başladığını iddia ediyor.
Evans ve giderek artan sayıda başka etikçi, germline ile somatik hücre düzenlemesi hakkında uzun süredir bilimsel düşünceyi ayıran ahlaki bölünmenin gözle görülür şekilde zayıfladığını iddia ediyor.
Çin'de CRISPR yoluyla insan embriyolarını genetik olarak değiştiren ve Lulu ve Nana olarak bilinen ikizler üreten He Jianqui'nin 2018 yılında yaptığı duyuru, tüm dünyada ciddi endişe yarattı ve germline gen düzenlemesi ile ilgili politikaların güçlendirilmesine yardımcı oldu. Küstahça insan deneyi yaptığı için dünya çapında kendisine yöneltilen küçümsemelere rağmen, araştırması aynı zamanda germline genlerin manipülasyonu konusunda daha ılımlı bir bakış açısının kapısının açılmasına yardımcı oldu. Politika yapıcılar, kalıtım genlerini içeren araştırmaların fizibilitesine ilişkin yönergeleri daha yumuşak bir tonda izlediler. Görünen o ki, hızla artan sayıda bilim insanı, germline DNA'daki genetik dizileri manipüle ederek potansiyel tedaviler geliştirmeye ilgi duyuyorlardı.
Evans PNAS'ta şöyle yazdı: "Şu anda, bilim politikaları üzerine en büyük etkiye sahip olan ana akım ABD ve Birleşik Krallık biyoetik tartışmasında, somatik/germ hattı ayrımı gücünü yitirdi. Çin, germline modifiye edilmiş çocukların doğumuna rağmen İkinci Uluslararası İnsan Germline Düzenleme Zirvesi'ne liderlik yaptı ve CRISPR'ın güvenli olduğu ve insan deneklerin korunmasına uyulduğu sürece, germline müdahalesi yapmanın prensipte kabul edilebilir olduğu konusunda benzer görüşlere sahipti."
Yeni bir tedavi sınıfı doğdu: Genomik düzenleme
Genomik düzenleme aslında bilim insanlarının bir organizmanın genetik kodunun bölümlerini "yeniden yazmasına" izin veren birkaç genetik teknolojiyi ifade eder. DNA dizileri silinebilir veya hemen hemen her genomik konumda eklemeler alabilir veya değiştirilebilir. Diğer genomik düzenleme teknolojilerinin aksine, CRISPR-Cas9 daha hızlı, daha verimli ve kullanımı daha kolaydır. Ve biyologların giderek artan bir şekilde söylediğine göre CRISPR, güçlü bir biyolojik araçla elde edilebilecekler konusunda yeni bir olasılıklar ufku açtı.
Bu sefer icat değil, "derin bir gözlem"
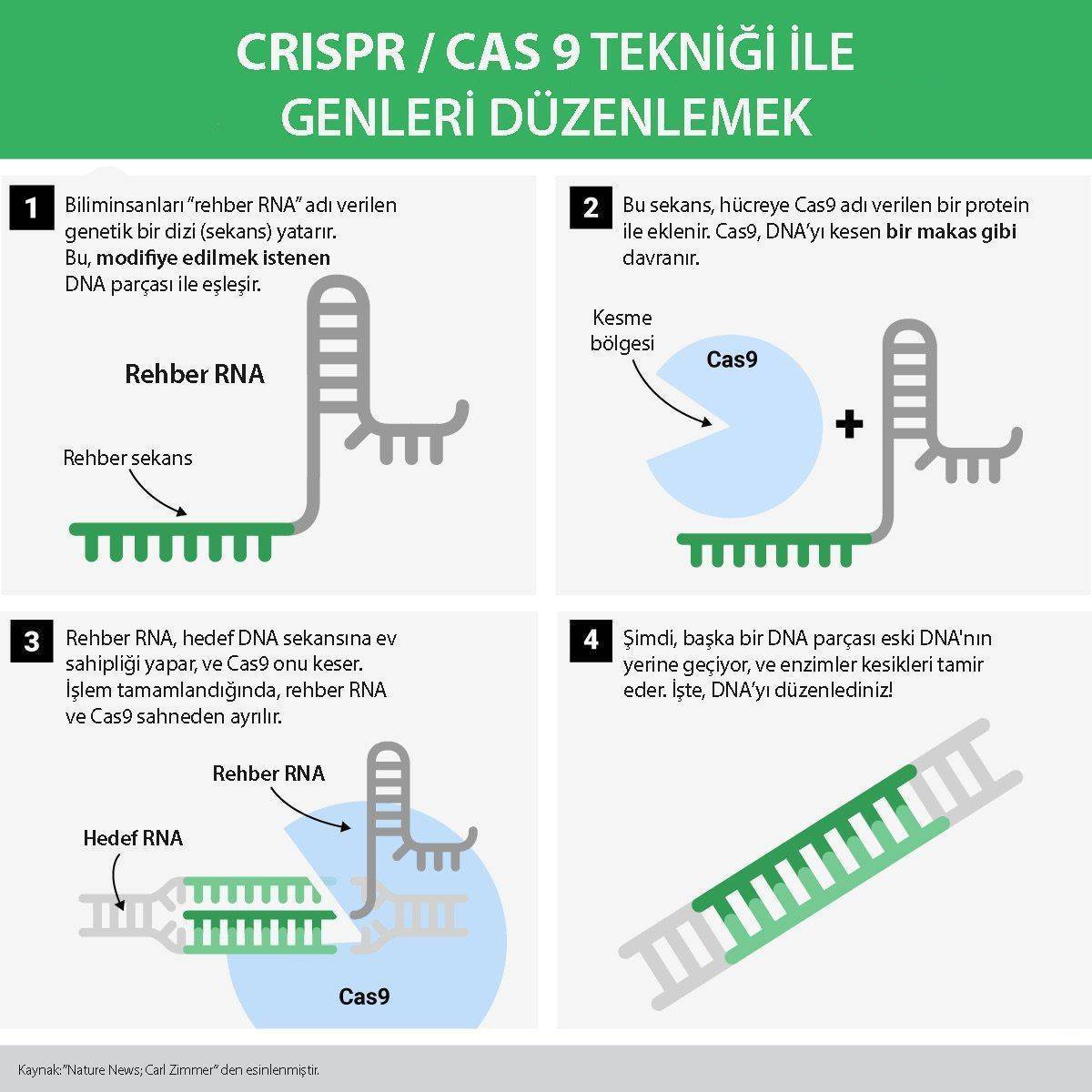
CRISPR yüksek teknoloji gibi görünse de, bir laboratuvarda icat edilmedi. Düzenleme tekniği aslında bakteri ve arkelerde bulunan doğal olarak oluşan bir genom düzenleme sisteminin bir uyarlamasıdır. Bu organizmalar, kendilerini istila eden virüslerden kelimenin tam anlamıyla sonsuz küçük genetik materyal dizilerini alır ve daha sonra bu yakalanan dizileri, CRISPR dizileri adı verilen DNA segmentleri oluşturmak için kullanır.
CRISPR adı verilen bu tekrarlayan diziler (genetik parçalar), bakteri ve arkelerin gelecekte istila edilmeleri durumunda virüsleri hatırlamalarına izin verir. Virüsler (bakteriyofajlar) tekrar saldırdığında, bakteri veya arke, CRISPR dizilerinden RNA üreterek viral genleri sıfırlar. Bakteriler ve arkeler daha sonra virüsü etkili bir şekilde yok eden viral genleri parçalamak için Cas9 adlı enzime güvenirler. Birçok yönden, bulaşıcı virüsleri hatırlama yeteneği, çok daha karmaşık memeli bağışıklık sisteminin bellek B ve T hücrelerine benzer şekilde hareket eden daha ilkel bir bağışıklık sistemi anlamına gelir.
Berkeley'deki California Üniversitesi'nden Jennifer Doudna ve Paris'teki Pasteur Enstitüsü'nden Emmanuelle Charpentier, CRISPR-Cas9'u içeren ortak çalışmaları nedeniyle 2020 Nobel Kimya Ödülü'nü kazandı. Teknoloji ilk olarak İspanya'daki Alicante Üniversitesi'nde profesör olan İspanyol biyolog Francis Mojica tarafından geliştirildi ve adlandırıldı, fakat ödülün alıcısı olarak dahil edilmedi.
Bu arada Evans, CRISPR'nin 2010'ların başında güçlü bir laboratuvar aracı olarak ortaya çıktığı zaman, "germline modifikasyonunun her zaman imkansız olacağı" yanılgısının hakim olduğunun altını çiziyor.
Evans, "Bazı bilim insanlarının laboratuvarda insan embriyolarını değiştirmek için CRISPR'ı kullanmaya çalıştıkları netleştikten sonra, birçok bilimsel grup, insan germline düzenlemesi üzerine, çoğunlukla zarar vermemeyi savunan belgeler yayınladı."
Örneğin, Evans'a göre, Ağustos 2015'te Amerikan Gen ve Hücre Tedavisi Derneği ve Japonya Gen Tedavisi Derneği, insan germline düzenlemesiyle ilgili "güvenlik ve etik kaygılar" sebebiyle, insan embriyo hücrelerinde gen düzenlemeye veya gen modifikasyonuna karşı duruş sergilediler.
CRISPR ile tedavi amaçlı ilk insan deneyleri başladı
CRISPR ile ilk insan klinik araştırmaları başladı. Intellia Therapeutics ve Regeneron Pharmaceuticals'dan bir araştırmacı ekibi, in vivo CRISPR insan "somatik" gen düzenlemesini içeren ilk klinik deneyi gerçekleştirdi. The New England Journal of Medicine'de yayınlanan makalelerinde grup, transtiretin amiloidoz (ATTR amiloidoz) hastalarını tedavi etmek için bir CRISPR tekniği geliştirmeyi ve faz 1 klinik denemesinin bir parçası olarak altı hastaya NTLA-2001 adlı bir tedaviyi uygulamayı anlattılar. Bu küçük çalışmanın sonuçları umut verici.
Sonuç
Etik kaygılara rağmen, CRISPR devrimi ile gen düzenleme hem insan hücrelerinde hem bitkilerde hem hayvanlarda uygulanmaya başlandı. Başlardaki sert duruş ve kaygılar yumuşamaya başladı. Çünkü CRISPR'ın her yıl dünya genelinde milyonlarca insanı etkileyen germline (kalıtsal) hastalıkların yönetimine ciddi şekilde fayda sağlama potansiyeli mevcut.
İnsanda ilk gen düzenleme klinik çalışması somatik gen düzenlemeyi içeriyor. Bu tedavi başarılı olma yolunda. Burada en önemli soru "gen düzenlemenin ne kadar süreceği". Farelerde 1 seneye kadar gen değişiklikleri sabit kalabiliyor, ama insanda daha önce hiç denenmedi. 28 gündeki sonuçlar olumlu. Germline düzenleme için endişeler mevcut. Herhangi bir ortak rehber yok. Çok açık bir uygulama rehberi belirlenmeli ki bunun için bilim insanları ve biyoetikçiler çalışıyor. Kalıtsal hastalıkların kesin tedavisi ancak germline genom düzenleme ile mümkün gözüküyor.
Genetik araçların giderek daha güçlü hale gelmesiyle, araçları neden kullandığımıza ve "yapılabilecekler yapılmalı"ya odaklanmalıyız.
1. John H. Evans. Setting ethical limits on human gene editing after the fall of the somatic/germline barrier, Proceedings of the National Academy of Sciences (2021).
2. Julian D. Gillmore et al, CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis, New England Journal of Medicine 26 June 2021.