
Niraparib ve Abirateron Kombinasyonu Prostat Kanserinde FDA Onayı Aldı
BRCA mutasyonu pozitif, metastatik kastrasyon dirençli prostat kanseri (mKDPK) olan yetişkin hastaların birinci basamak tedavisi için niraparib ve abiraterone asetat (Akeega, Janssen Pharmaceuticals) 11 Ağustos 2023'te FDA (ABD Gıda ve İlaç İdaresi) onayı aldı.
Prostat kanseri, akciğer kanseri ile birlikte erkeklerde en yaygın iki kanser türünden biridir. Özellikle BRCA gen mutasyonu taşıyan hastalar ki bu grup, metastatik kastrasyon dirençli prostat kanseri geliştiren hastaların %10-15'i ifade eder, daha agresif bir hastalık seyri ve kötü sonuçlarla karşılaşabilirler. Bu bağlamda, yeni tedavi seçeneklerinin geliştirilmesi hayati öneme sahiptir. Aşağıda, FDA'nın onayladığı yeni bir kombinasyon tedavi yönteminin detayları sunulmaktadır.
İlgili konu: Kastrasyona Dirençli Prostat Kanseri (KDPK) Nedir?
MAGNITUDE Çalışması ile Gelen FDA Onayı
FDA'nın onayı, faz 3 MAGNITUDE adlı klinik araştırmanın bulgularına dayanmaktadır.
MAGNITUDE çalışmasının 1. Grubunda, homolog rekombinasyon onarımı (HRR) geni mutasyonlu mKDPK'li 423 hastaya randomize, çift kör, plasebo kontrollü bir deneme yapıldı.
Hastalar 1:1 oranın rastgele iki kola ayrıldı:
- Deney kolu: niraparib 200 mg ve abiraterone asetat 1000 mg artı prednizon 10 mg günlük ve
- Kontrol kolu: plasebo ve abiraterone asetat artı prednizon günlük aldı.
Hastaların önceden orşiektomi geçirmiş olmaları veya gonadotropin salgılatıcı hormon (GnRH) analogları alıyor olmaları gerekiyordu.
Hastaların Seçimi
mKDPK'li hastalar, mKDPK ayarında daha önce sistemik tedavi almamışlarsa çalışmaya uygun kabul edildi. Hastalar, daha önceki hastalık aşamalarında dosetaksel veya androjen reseptörü (AR) hedefli tedaviler almış olabilirlerdi. Randomizasyon (rastgele atama), önceki dosetaksel, önceki AR hedefli tedavi, önceki abiraterone asetat artı prednizon ve BRCA durumuna göre düzenlendi.
MAGNITUDE Çalışmanın İkinci Ara Analiz Sonuçları
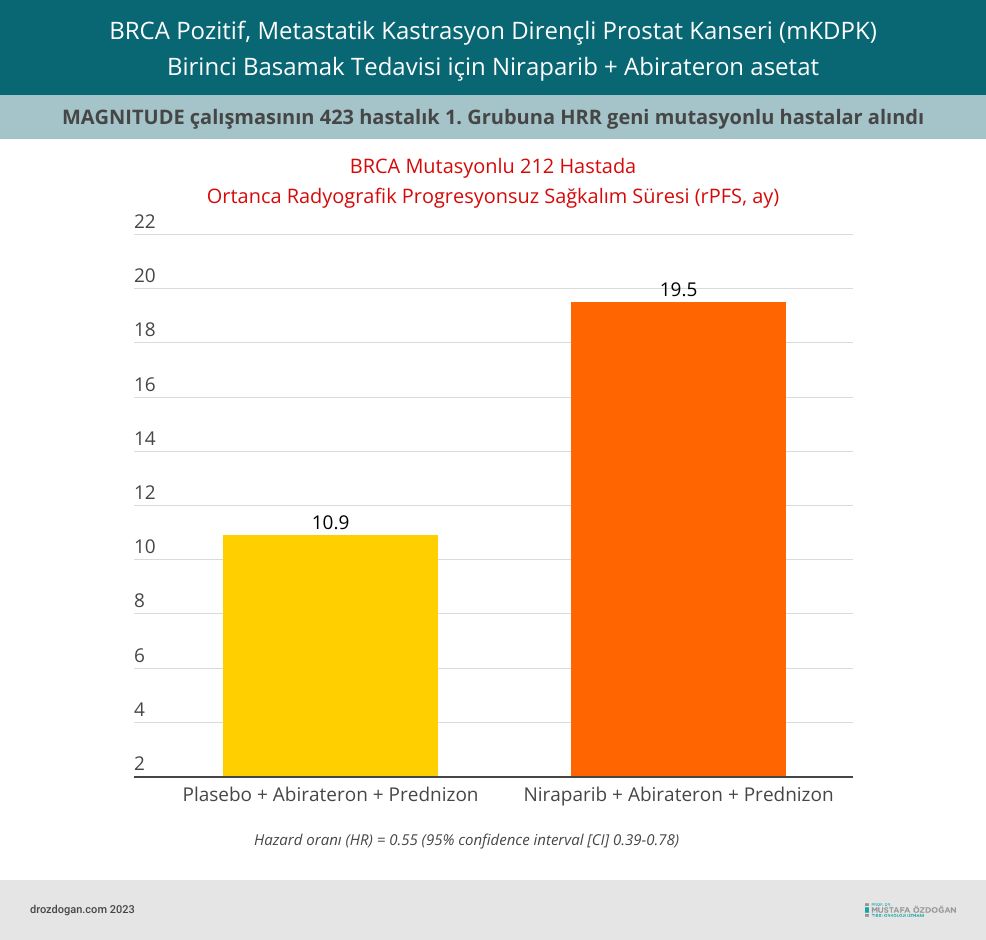
- BRCA Mutasyonlu Hastalar: 423 hastanın 212'si önceden belirlenmiş BRCA gen mutasyonlarına (BRCAm) sahipti. HRR gen mutasyonu olmayan mKDPK hastalarında (MAGNITUDE'nin 2. Grubu) fayda gözlemlenmedi.
- Niraparib + abirateton + prednizon (deney kolu) alan BRCA1/2 pozitif mKDPK'de (ortanca takip süresi 24.8 ay) radyografik ilerleme/ya riskini %45 azalttı.
- Ana Etkililik Ölçümü: Çalışmanın ana sonlanım noktası radyografik progresyonsuz sağkalım (rPFS) iken genel sağkalım (GS) ikinci sonlanım noktası idi.
- İstatistiksel İyileşme: BRCA gen mutasyonu olan hastaların ortanca radyografik progresyonsuz sağkalımı (rPFS) deney kolunda 19,5 ay iken, kontrol kolunda 10,9 aydı (hazard oranı [HR] = 0.55 [95% confidence interval [CI] 0.39-0.78).
- BRCAm Hastalarında GS Analizi: Ortanca 30,4 aya karşı 28,6 ay idi (HR 0.79; %95 CI: 0.55, 1.12). Bu sonuç da deney kolu lehine idi.
- Tüm hasta grubunda rPFS: BRCA-dışı HRR mutasyonlu 198 (%47) hastanın alt grubunda, rPFS tehlike oranı 0.99 (95% CI: 0.67, 1.44) ve GS tehlike oranı 1.13 (95% CI: 0.77, 1.64) idi, bu da iyileşmenin esas olarak BRCAm hastalarda olduğunu gösterdi.
Yan Etkiler
MAGNITUDE çalışmasının 1. Grubunda niraparib ve abiraterone asetat artı prednizon ile tedavi edilen mKDPK'li hastalarda (%20 veya daha fazla) en yaygın yan etkiler ve laboratuvar anormallikleri şunlardı:
- Hemoglobin azalması
- Lenfosit azalması
- Beyaz kan hücrelerinin azalması
- Kas-iskelet ağrısı
- Yorgunluk
- Trombosit azalması
- Alkalen fosfataz artışı
- Kabızlık
- Hipertansiyon
- Mide bulantısı
- Nötrofil azalması
- Kreatinin artışı
- Potasyum artışı
- Potasyum azalması
- AST artışı
Kan Transfüzyonu İhtiyacı
Hastaların %27'si kan transfüzyonu gerektirdi, bunların %11'i birden fazla transfüzyon gerektirdi.
Dozaj ve Kullanım Talimatları
Önerilen doz, hastalık ilerlemesi veya kabul edilemez yan etki oluşana kadar günde bir kez 200 mg niraparib ve 1000 mg abiraterone ile 10 mg prednizon kombinasyonudur.
Sonuç: Geleceğe Yönelik Adımlar
Bu yeni onay, prostat kanseri tedavisinde önemli bir adımı temsil etmektedir. Özellikle BRCA gen mutasyonu taşıyan hastalar için, bu kombinasyon tedavisi, hastalığın ilerlemesini yavaşlatabilir ve yaşam süresini uzatabilir. Ayrıca, bu tedavi yaklaşımı, daha önce BRCA mutant prostat kanserinde abirateron, kortikosteroid ve olaparib FDA onayı ve HRR gen mutasyonlu ileri evre prostat kanserinde talazoparib ve enzalutamid FDA onayı gibi önemli gelişmelerle birlikte değerlendirildiğinde, prostat kanseri tedavisindeki yenilikçi yaklaşımların bir parçası olarak görülmektedir.
Bu gelişmeler, prostat kanseri tedavisinde yeni ufuklar açmakta ve hastalar için daha etkili tedavi seçenekleri sunmaktadır. Umarım, bu ve benzeri çalışmalar, kanserle mücadelede daha etkili ve kişiye özel tedavi yöntemlerinin geliştirilmesine katkı sağlayacaktır.
1. FDA approves niraparib and abiraterone acetate plus prednisone for BRCA-mutated metastatic castration-resistant prostate cancer. fda.gov 11 August 2023
2. Chi KN, Sandhu S, Smith MR, et al. Niraparib plus abiraterone acetate with prednisone in patients with metastatic castration-resistant prostate cancer and homologous recombination repair gene alterations: second interim analysis of the randomized phase III MAGNITUDE trial. Ann Oncol. 2023 Jul 1:S0923-7534(23)00757-3. doi: 10.1016/j.annonc.2023.06.009. Epub ahead of print. PMID: 37399894.






