Tümörü İstila Eden T-hücreleri ve Kanserde Önemi
İmmünoterapiler, ileri evre kanserlerin yönetimini ve onkolojinin kaderini değiştirmiştir. Ancak yine de hastaların hepsi, bu ajanlardan uzun süreli klinik fayda görmemektedir. T hücreleri, anti-tümör bağışıklığın birincil aracılarıdır ve immünoterapilere yanıtta merkezi bir rol oynamaktadır. Ancak önemli tedavi gelişmelerine rağmen, farklı tür tümörlerde tümörü infiltre / istila edici T hücrelerinin özelliklerini, fonksiyonunu ve bu hücrelerin klinik sonuçları nasıl etkilediklerini hala tam olarak anlamış değiliz.
Son yıllarda tek hücreli RNA sekanslama analizleri (scRNA-seq), çeşitli tümörlerin ve onları infiltre eden bağışıklık hücrelerinin hücresel kompozisyonu ve özelliklerine eşi benzeri görülmemiş bir bakış açısı sağlamıştır.
Fare modellerinde kronik viral enfeksiyon ve melanom çalışmaları, yüksek derecede işlevsiz, "terminal olarak tükenmiş" CD8+ T hücrelerinin yanı sıra çoğalma ve farklılaşma yeteneğine sahip öncül ve ara form olarak meydana gelen T hücre popülasyonlarını ortaya çıkarmıştır.
Ayrıca, insan tümör tipleri üzerine olan çalışmalar, örneğin melanomu olan hastalarda immünoterapiye yanıtta öncül CD8+ T hücrelerin rolünü ve renal hücreli karsinomu olan hastalarda T hücrelerinin gelişimini ortaya çıkarmıştır.
Ancak T hücrelerinin fenotipleri ve çeşitli tümör tiplerine karşı tekrarlayan popülasyonları, geniş ölçüde tanımlanmamış olarak kalmıştır. Tümörlerin heterojen bağışıklık yapılarının Pekin Üniversitesi’nden Liangtao Zheng ve ekibi tarafından yapılan ve NEJM'de yayımlanan güncel ve kapsamlı bir tanımlaması, bu yüzden hem istenilen hem de iyi düzeyde bir gelişmeydi.
Tümör İmmünitesine Derin Bir Bakış
Zheng ve ekibi, 316 hastadan alınan 397 bin tümör infiltre edici veya dolaşımdaki T hücrelerinden elde ettikleri scRNA-seq verilerilerini (ve varsa T hücre reseptör verileri) entegre ederek 21 kanser türünden oluşan bir pankanser atlası oluşturdu.
Araştırmacılar, tümörlerde yüksek çeşitlilikte CD8+ ve CD4+ T hücresinin fenotipi buldu. CD8+ T hücreleri arasında tükenmiş fenotipe sahip 4 hücre popülasyonu, tümörlerde zengin miktardaydı.
Hücre farklılaşma gidişatının hesaplamalı çıkarımı aracılığı ile araştırmacılar, çoğu kanser türünde naif T hücresi aktivasyonundan son aşamaya veya terminal CD8+ T hücre tükenmesine kadar iki potansiyel yolak tespit etti;
- Birinci yol, GZMK (gran-zyme K) mesajcı RNA (mRNA)-pozitif efektör bellek T hücresi popülasyonundan geçerken
- İkinci yol, ZNF683 (zinc finger 683) mRNA pozitif dokuya yerleşik bellek T (Tm) hücresi popülasyonundan geçmekteydi.
Bu geniş kapsamlı yolaklar çoğu kanser türünde bulundu ancak bireysel tümörler her iki yolu da tercih etmiştir. Çalışmada yer alan ekibin de beklediği gibi kanser türüne spesifik ve T hücre tükenmesine yol açan ek yolaklar tanımlanmıştır.
Zheng ve ekibi ayrıca tümör dokusunda zengin miktarda potansiyel olarak tümör reaktif CD4+ T hücreleri – INFG (interferon gama) mRNA pozitif folliküler yardımcı T/tip 1 yardımcı T (Th1) hücreleri ve TNFRSF9 (tümör nekroz faktörü reseptörü süper aile üyesi 9) mRNA-pozitif düzenleyici hücreler için hesaplamalı olarak sonuç çıkardı. Bu CD4+ T hücre popülasyonları, tümörde CD8+ T hücre popülasyonları ile birlikte meydana gelmiş ve bu T hücre modülünün tip 1 interferonlara ve dönüştürücü büyüme faktörü β’ya yanıt verdiği görülmüştür. Bu bulgu, infiltre edici T hücrelerinin fenotipini şekillendirmede tümör mikro-çevresinin bir rolü olduğunu düşündürmektedir. Bu bulgudan yola çıkarak araştırmacılar, infiltre edici tümör hücrelerinin kompozisyonu etkilemiş olan klinik (vücut kitle indeksi gibi) ve somatik tümör (tümör mutasyon yükü ve FAT1 mutasyonu) özelliklerini tanımladı.
Son olarak tüm tümörlere karşı T hücre kompozisyonunu analiz ederek 2 ana tümör grubu tanımladı;
- birinde bellek T hücreleri yüksekti ve
- diğerinde ise CD8+ T hücreleri zengindi.
Harici veri setlerinde CD8+ T hücreleri yönünden zengin olan tümörler, kötü hasta sağkalımı ve melanom hastalarında PD-1 blokajına (immünoterapiye) karşı azalan yanıt ile ilişkiliydi.
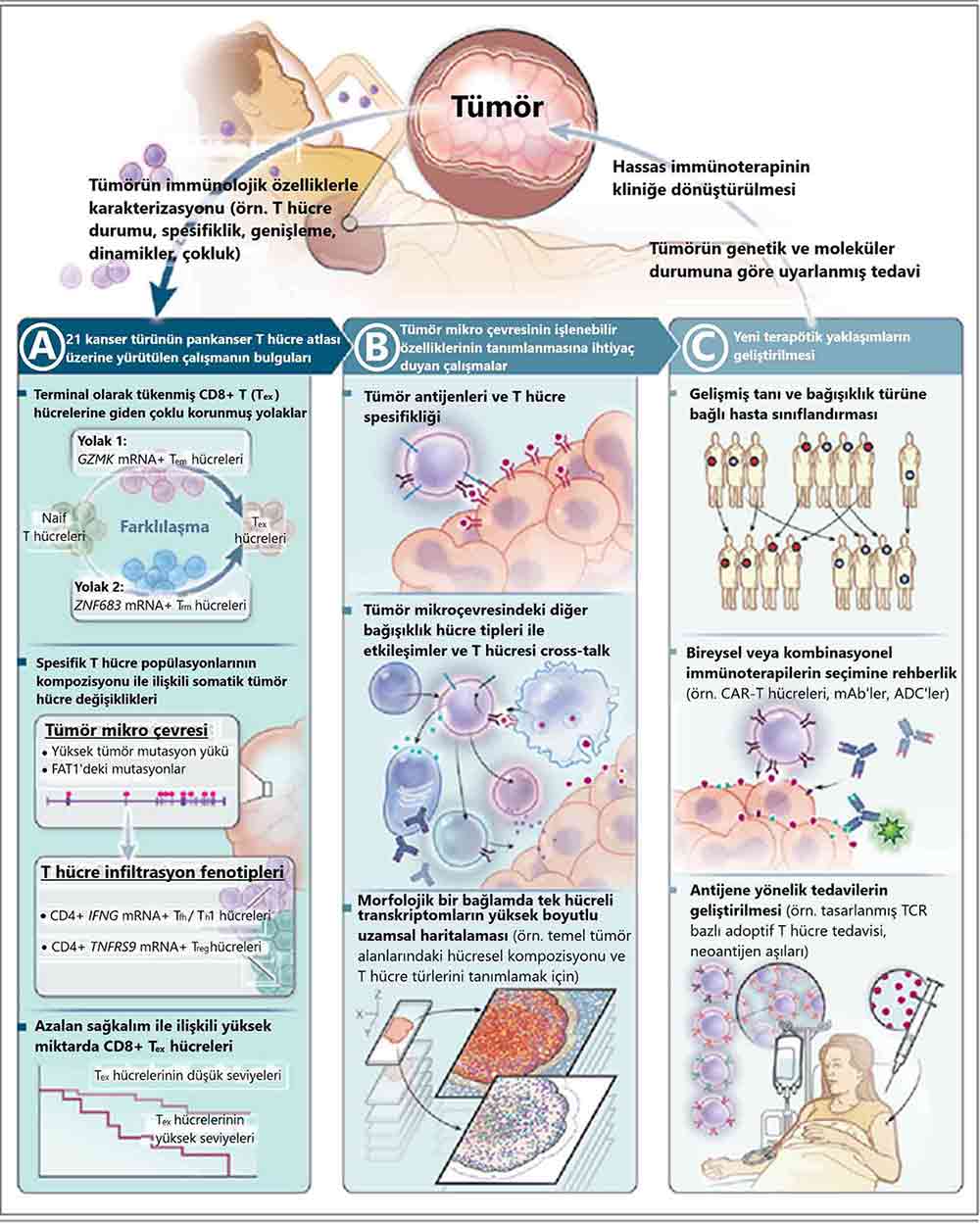
Şekil 1: Kanser Bağışıklık Mikro-çevresinin Haritalanması
A Kolonu: İmmüno-onkoloji alanındaki bilimsel çalışmalar, hastadan elde edilen biyolojik örnekleri, yeni terapötikler oluşturmak amacıyla insan tümör immünobiyolojisinin mekanizma olarak anlaşılmasını geliştirmek için kullanır. Son dönemlerde Zheng ve ekibi, tümör infiltre edici T hücrelerinin pankanser haritası yayımlamıştır.
B Kolonu: Tek hücreli RNA sekanslama analizleri aracılığıyla terminal olarak tükenmiş CD8+ T hücrelerine giden çoklu korunmuş yolaklar, somatik değişiklikler ile diğer mikro-çevresel özellikler ve spesifik T hücre popülasyonları arasında bir bağlantı ve terminal olarak tükenmiş CD8+ T hücrelerinin yüksek infiltrasyonu ile birden fazla kanser türündeki daha kötü hasta sağkalımı arasında bir ilişki tanımladılar. Spesifik bağışıklığın "ilk örneklerini" de içeren, tümörlerin genetik ve moleküler durumuna göre uyarlanmış immünoterapiler sağlamak için tümör antijenlerinin tanımlanması, aynı türden olan T hücrelerinin spesifikliğinin belirtilmesi ve bireysel hücresel popülasyonların ve T hücre türlerinin uzamsal lokasyonlarının haritalanması gibi tümörlerin bağışıklık mikro-çevresine yönelik açıklamalar gerekli olacaktır.
C Kolonu: Ortaya çıkan veriler, kanser hastaları için tanısal yöntemlerin, tahmin etmeye yönelik belirtilerin ve immünoterapilerin rasyonel kombinasyonları ve yeni antijene spesifik terapötik yaklaşımlar gibi müdahale yöntemlerinin geliştirmesi amacı ile kullanılmalıdır.
ADC’ler, antikor-ilaç konjugatları; CAR, kimerik antijen reseptörü; mAB’ler, monoklonal antikorlar; mRNA, mesajcı RNA; TCR, T hücre reseptörü; Tem, efektör bellek T hücresi; Tfh, foliküler yardımcı T hücre; Th1, tip 1 yardımcı T hücre; Treg, düzenleyici T hücre; ve Trm, dokuda yerleşik bellek T hücresi.
Zorlu da olsa elde edilen bu hesaplamalı başarı, tümörleri sadece histolojik özellikleri ile değil aynı zamanda bağışıklık hücrelerinin kompozisyonu ile de tanımlamaya yönelik ilk ve büyük bir adım atmaktadır.
Nihayetinde korunmuş immünolojik özelliklerin açıklaması (bağışıklık hücrelerin ilk örnekleri olarak bilinir), antijene yönelik tedaviler – özellikle hedef tümör epitopları – ile uyum içindeki spesifik immünopatolojik mekanizmaları hedefleyen bireysel veya kombinasyonel tedavilerin seçimine rehberlik edebilecek hassas immünoterapilere yol açacak yeni yaklaşımların geliştirilmesini sağlayabilir (Şekil 1).
Bununla birlikte, tümörün bu tür hesaplamalı karakterizasyonundan tümör mikro-çevresinin işleme uygun özelliklerinin tanımlanmasına kadar olan boşluğu doldurmak, önerilen etkileşimlerin ve farklılaşma yolaklarının fonksiyonel olarak doğrulanmasını ve hücresel fenotiplerin ek bilgi katmanlarıyla entegrasyonunu gerektirecektir.
Biyokimyasal bir seviyede RNA ekspresyonu, proteini fonksiyonel olarak etkileyen birkaç faktörden biridir. Ayrıca anti-tümör etki yaratmak adına T hücrelerinin spesifik tümör antijenlerini tanıması ve bağışıklık baskılayıcı hücre-hücre etkileşimlerinin üstesinden gelmesi de gereklidir. Bu yüzden anti-tümör T hücrelerinin spesifik hedefleri, hücresel etkileşimleri ve uzamsal lokasyonları açısından fonksiyonel bilgi çerçevesinin geliştirilmesi, T hücre alt gruplarının hastalarda hastalığın seyri üzerine olan etkisinin anlaşılması ve etkili kanser immünoterapilerinin geliştirilmesi için kritik olacaktır.
Zheng ve ekibi tarafından tanımlanan pankanser tümör infiltre edici T hücre çerçevesi, tümörlerin immünolojik özelliklerine göre yapılacak gelecek tanımlar için önemli bir temel kaynak sağlamaktadır. Kesinlikle bu tür analizler, mevcut immünoterapilere karşı verilen yanıt ve gelişen direnç mekanizmalarına yönelik gelecek araştırmalara ve yeni terapötik yaklaşımların geliştirilmesine katkı sağlayacaktır.
Braun, D. A., & Wu, C. J. (2022). Tumor-Infiltrating T Cells—A Portrait. New England Journal of Medicine, 386(10), 992-994.v