2023'ün En Önemli Gelişmesi, Ameliyat Edilebilir Akciğer Kanserinde İmmünoterapi
2023 yılı, ameliyat edilebilir akciğer kanseri tedavisinde önemli bir dönüm noktası oldu. Bu yıl, ameliyat edilebilir küçük hücreli dışı akciğer kanseri (KHDAK) tedavisinde immün kontrol noktası inhibitörleri sınıfından immünoterapilerin kullanıldığı çeşitli önemli klinik çalışmalar rapor edildi.
Cerrahi öncesinde başlatılan bu immünoterapi yöntemleri, daha önce herhangi bir tedavi görmemiş hastalarda iki önemli amaca hizmet eder:
- Ana tümörün daha fazla küçülmesini sağlayarak cerrahi yolla daha kolay ve etkin bir şekilde çıkarılmasını sağlamak,
- Bağışıklık sisteminin tümörü tanımasını ve sistemik bir anti-tümör bağışıklık yanıtını tetiklemek.
Böylelikle immünoterapiler, cerrahi sonrası kanserin tekrarlama riskini azaltmayı amaçlar.
Ameliyat edilebilir KHDAK'lerde immünoterapilerin denendiği güncel klinik çalışmalar şunlardır:
- IMpower010 (atezolizumab),
- AEGEAN (durvalumab),
- CheckMate 77T (nivolumab),
- CheckMate 816 (nivolumab),
- KEYNOTE-671 (pembrolizumab) ve
- Neotorch (toripalimab) çalışmaları.
Daha önce ileri evre akciğer kanserleri için immünoterapilerin etkili olduğunu biliyorduk, ancak bu çalışmalar, erken evre akciğer kanseri tedavisinde immünoterapinin etkili olduğunu gösterdi.
Bu klinik çalışmaların çoğunun takip süresi kısadır ve şu anki odak noktası, olaydan bağımsız sağkalım (EFS= event free survival) idi. Ayrıca, büyük patolojik yanıt (mPR= major pathologic response) veya patolojik tam yanıtın (pCR= pathologic complete response) potansiyel öngörü değeri de incelendi.
- Event-Free Survival (EFS), olaydan bağımsız sağkalımdır. Yani, kanser tedavisinde hastanın herhangi bir hastalık ilerlemesi, tekrarı veya yaşam kaybı gibi istenmeyen olaylar yaşamadan geçirdiği süreyi ifade eder.
- Major Pathologic Response (mPR), büyük patolojik yanıttır. Kanser tedavisi sonrasında, cerrahi ile alınan tümör dokusunda kalan kanser hücrelerinin miktarının önemli ölçüde azalmasını ifade eder.
- Pathologic Complete Response (pCR), patolojik tam yanıttır. Kanser tedavisi sonrasında, cerrahi ile alınan tümör dokusunda kanser hücrelerinin tamamen yok olması durumunu ifade eder.
Bu çalışmaların çoğunda immünoterapiler, neoadjuvan (ameliyat öncesi) veya perioperatif (ameliyat öncesi ve sonrası) dönemde kemoterapiye ek olarak kullanıldı.
Erken evre akciğer kanserinde immünoterapi kullanımına dair şimdiye kadarki FDA onayları şu şekildedir:
| Etken Madde (Kutu Adı) | Klinik Çalışma | FDA Onay Tarihi | Kullanım Alanı | Çalışma Detayları | Sonuçlar |
| Atezolizumab (Tecentriq) | IMpower010 | 15.10.2021 | Adjuvan onay. PD-L1 ≥ %1, evre II-3A KHDAK hastalarında platin bazlı kemoterapi sonrası. | 1005 hastanın katılımıyla randomize, çok merkezli, açık etiketli. | Olaysız sağkalım süresi (EFS): Ortanca süre atezolizumab kolunda ulaşılmadı; kontrol kolunda 35,3 ay. Kanserin tekrarlama riski %44 azaltıldı. |
| Nivolumab (Opdivo) | CHECKMATE-816 | 04.03.2022 | Neoadjuvan onay. Rezektabl (tümör ≥4 cm veya nod pozitif) KHDAK hastalarında. | Randomize, açık etiketli çalışmaya 358 hasta alındı. | EFS: Nivolumab+kemoterapi kolunda ortanca 31.6 ay, sadece kemoterapi kolunda 20.8 ay. Patolojik tam yanıt oranı %24 (nivolumab+kemoterapi) vs %2.2 (sadece kemoterapi). |
| Pembrolizumab (Keytruda) | KEYNOTE-091 | 27.01.2023 | Adjuvan onay. Evre IB, II veya IIIA KHDAK hastalarında. | 1177 hastanın katılımıyla randomize, üçlü kör, plasebo kontrollü. | EFS: Pembrolizumab kolunda ortanca 58,7 ay, plasebo kolunda 34,9 ay. |
| Pembrolizumab (Keytruda) | KEYNOTE-671 | 16.10.2023 | Perioperatif onay. Rezektabl (tümör ≥4 cm veya nod pozitif) KHDAK hastalarında. | 797 hastanın katılımıyla randomize, çift kör, plasebo-kontrollü. | Genel sağkalım ve EFS: Pembrolizumab kolunda ortanca süreler henüz ulaşılmadı, plasebo kolunda EFS 17 ay. Kanserin ilerlemesi, tekrarı veya yaşam kaybı riski %42 azaltıldı. |
| Durvalumab (Imfinzi) | AEGEAN | 15.08.2024 | Perioperatif onay. Rezektabl (tümör ≥4 cm ve/veya nod pozitif) KHDAK hastalarında. | 802 hastanın katılımıyla randomize, çift kör, plasebo-kontrollü. | Ortanca EFS durvalumab kolunda ulaşılamadı, plasebo kolunda ise 25.9 ay. Kanserin ilerlemesi, tekrarı veya yaşam kaybı riski %32 azaltıldı. pCR oranları %17'ye karşı %4.3. |
Çalışmaların Özet Sonuçları
IMpower010 çalılması, adjuvan (ameliyat sonrası) ortamda yalnızca kemoterapiye karşı atezolizumab ile kemoterapinin birleştirildiği tek deneydir. İlk ara genel sağkalım analizinin sonuçları yakın zamanda yayınlandı ve ortanca 45.3 aylık takip süresinden sonra tüm deney grubunda bir genel sağkalım faydası göstermedi. Yalnızca, PD-L1 %50 ve üstü olan bir hasta alt grubunda yaşam kaybı oranında %57 azalma gösterdi. Bu çalışma sonrası atezolizumab, 15 Ekim 2021'de tümör hücrelerinin PD-L1 değeri ≥ % 1 olan, evre 2 – 3A KHDAK adjuvan tedavisi için FDA onayı alan ilk immünoterapi olmuştu.
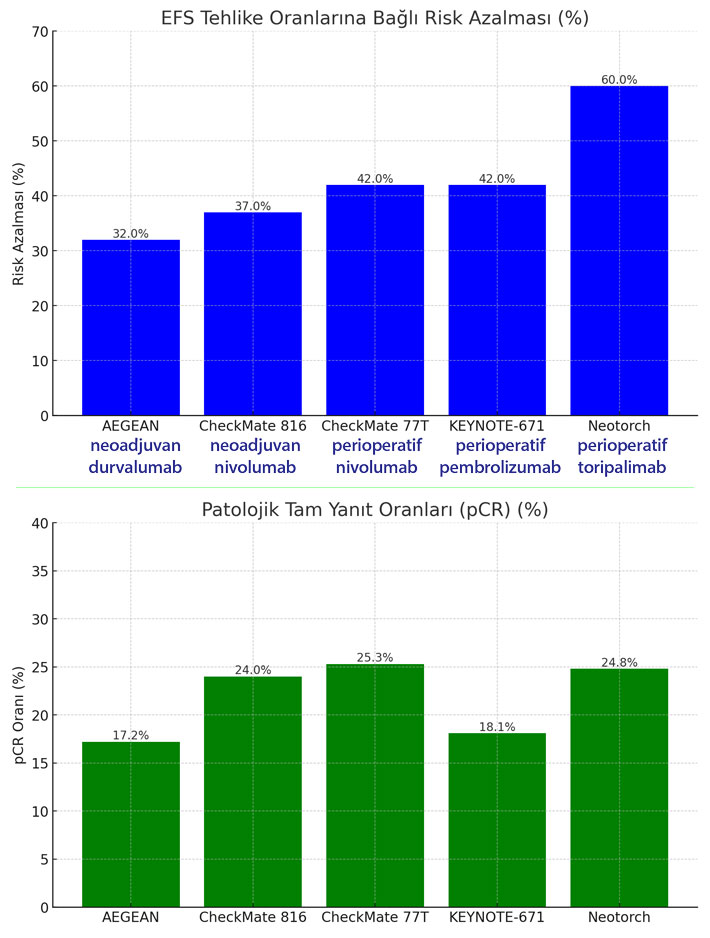
AEGEAN, neoadjuvan ortamda kemoterapi ile birleştirilen durvalumabın kullanıldığı perioperatif bir deneydir. Birincil sonlanım noktaları EFS ve pCR oldu. Kemoterapiye durvalumab eklenmesi ile EFS tehlike oranı 0.68 saptandı.
Burada belirtilen "EFS tehlike oranı 0.68" ifadesi, durvalumab eklenmesiyle, hastaların kanser nedeniyle sağlık durumlarında kötüleşme, kanser tekrarı veya yaşam kaybı gibi istenmeyen olaylar yaşama riskinin, durvalumab eklenmeyen kontrol grubuna göre %32 oranında azaldığını gösterir.
pCR oranı durvalumab ile %17.2'ye karşılık plasebo ile %4.3'tür ve mPR, durvalumab ile tedavi edilen hastalarda %33.3'e karşılık plasebo ile tedavi edilenlerde %12.3'tür.
CheckMate 816, nivolumabın neoadjuvan ortamda kemoterapiye eklendiği tek deneydir. Ameliyat sonrası ek kemoterapi veya radyoterapiye izin vardı ancak zorunlu değildi. İki eş birincil sonlanım noktası vardı: EFS ve mPR. En az 21 aylık bir takip süresi ile EFS için tehlike oranı 0.63 idi ve bu istatistiksel olarak anlamlıydı. pCR oranı, kemoterapiye nivolumab eklenmesi lehine %24'e karşılık %2.2'dir ve bu fayda tüm alt gruplarda görüldü. İlginç bir şekilde, pCR olan hastalarda EFS için tehlike oranı 0.13'tür.
CheckMate 77T, CheckMate 816'ya benzer bir tasarıma sahiptir ancak nivolumab, adjuvan ortamda da perioperatif yaklaşımda eklendi. Ortanca 25.4 aylık bir takip süresi ile EFS tehlike oranı 0.58'dir (CheckMate 816'ya göre 5 puanlık bir iyileşme, muhtemelen adjuvan nivolumaba eklenmesine atfedilebilir, ancak çapraz deneme karşılaştırmasının doğal sınırlılıkları ile). pCR oranı %25.3 olup, CheckMate 816'da görülenlere oldukça benzerdir ve pCR elde eden alt grupta EFS tehlike oranı 0.33'tür.
KEYNOTE-671, pembrolizumab ve kemoterapiyi CheckMate 77T'ye benzer bir perioperatif tasarımda test etti. Ortanca 25.2 aylık bir takip süresi ile EFS tehlike oranı 0.58'dir. Pembrolizumab ve kemoterapi grubundaki hastaların %30.2'sinde mPR gözlemlendi, plasebo grubundaki hastaların ise %11'inde. pCR değerleri, pembrolizumab lehine %18.1'e karşılık %4'tür. Verilerin yayınlanma zamanında genel sağkalım, istatistiksel olarak anlamlı bir farklılık göstermemiş olup, genel sağkalım verileri henüz olgun değildi ve daha uzun bir takip süresi gerektirecektir, sağkalım eğrileri yaklaşık 24. ayda ayrılmaya eğilimindeydi.
Neotorch, ameliyat edilebilir KHDAK'ye sahip Çinli hastaları kapsayan bir Çin deneyidir. Toripalimab, bir anti–PD-1 monoklonal antikorudur. Neotorch faz III peroperatif deneyinde, platin tabanlı kemoterapiyi takiben toripalimab idame tedavisi ile birleştirilen toripalimab, kemoterapi ile karşılaştırıldı. EFS ve mPR, eş birincil sonlanım noktalarıdır. 18.3 aylık ortanca bir takip süresi ile yapılan ara analizde EFS için tehlike oranı 0.40, mPR %48.5'e karşılık %8.4 ve pCR %24.8'e karşılık %1 olup, toripalimab lehine tüm alt gruplarda üstünlük gösterdi.
Aşağıda, çalışmaların sonuçlarının indirekt karşılaştırması görülebilir:
Sonuç
2023 yılında, erken evre ve ameliyat edilebilir küçük hücreli dışı akciğer kanserinde (KHDAK) immünoterapilerin etkinliği konusunda pek çok önemli araştırma yayımlandı. Bu çalışmalar, immünoterapinin faydalarını ve güvenliğini, cerrahi dahil, tutarlı bir şekilde ortaya koydu. EFS (olaydan bağımsız sağkalım) oranlarında gözle görülür iyileşmeler gözlendi. mPR (büyük patolojik yanıt) ve pCR (patolojik tam yanıt) önemli başarı göstergeleri olarak değerlendirildi. Çalışmaların daha uzun süreli takibi, genel sağkalım üzerindeki etkileri daha iyi anlamamıza yardımcı olacaktır. Tümörün detaylı patolojik analizi, ileri biyoinformatik çalışmalar ve yeni biyobelirteçlerin keşfi, tedavinin başarısını öngörmekte kritik öneme sahiptir.
Sonuç olarak ameliyat edilebilir küçük hücreli dışı akciğer kanserinin tedavisine immünoterapilerin eklenmesi artık yeni tedavi standardı haline gelmektedir.
1. Felip E, Altorki N, Zhou C, et al. Overall survival with adjuvant atezolizumab after chemotherapy in resected stage II-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase III trial. Ann Oncol. 2023;34(10):907-919.
2. Heymach JV, Harpole D, Mitsudomi T, et al. Perioperative Durvalumab for Resectable Non-Small-Cell Lung Cancer. N Engl J Med. 2023;389(18):1672-1684.
3. Forde PM, Spicer J, Lu S, et al. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med. 2022;386(21):1973-1985.
4. Cascone T, Awad MM, Spicer JD, et al. LBA1 - CheckMate 77T: Phase III study comparing neoadjuvant nivolumab (NIVO) plus chemotherapy (chemo) vs neoadjuvant placebo plus chemo followed by surgery and adjuvant NIVO or placebo for previously untreated, resectable stage II–IIIb NSCLC. Paper presented at: 2023 ESMO Congress; October 20–24, 2023; Madrid, Spain. Abstract LBA1.
5. Wakelee H, Liberman M, Kato T, et al. Perioperative Pembrolizumab for Early-Stage Non-Small-Cell Lung Cancer. N Engl J Med. 2023;389(6):491-503.
6. Lu S, Wu L, Zhang W, et al. Perioperative toripalimab + platinum-doublet chemotherapy vs chemotherapy in resectable stage II/III non-small cell lung cancer (NSCLC): Interim event-free survival (EFS) analysis of the phase III NEOTORCH study. Paper presented at: 2023 ASCO Plenary Series; April 20, 2023. Abstract 425126.