Dabrafenib (Tafinlar) Nedir? FDA Onayı, Türkiye Ruhsatı ve Geri Ödeme Durumu
- FDA Onaylı: Evet (İlk onay tarihi: 29 Mayıs 2013)
- Kutu Adı: Tafinlar
- Etken Madde Adı: Dabrafenib
- Uygulama Şekli: Oral
- Sınıfı: Sinyal Transdüksiyon İnhibitörü, BRAF İnhibitörü
- Kategori: Hedefe yönelik ajan
- Üretici: Novartis
- Türkiye Dağıtımı: Novartis Sağlık, Gıda ve Tarım Ürünleri San. Ve Tic. A.Ş.
- Onaylı Olduğu Kanserler: BRAF V600E mutasyonu taşıyan melanom, küçük hücreli dışı akciğer kanseri, anaplastik tiroid kanseri, düşük dereceli gliom ve yine bu mutasyonu taşıyan ileri evre tümör agnostik solid tümörler.
Dabrafenib (Tafinlar) Nedir? Etki Mekanizması Nasıldır?
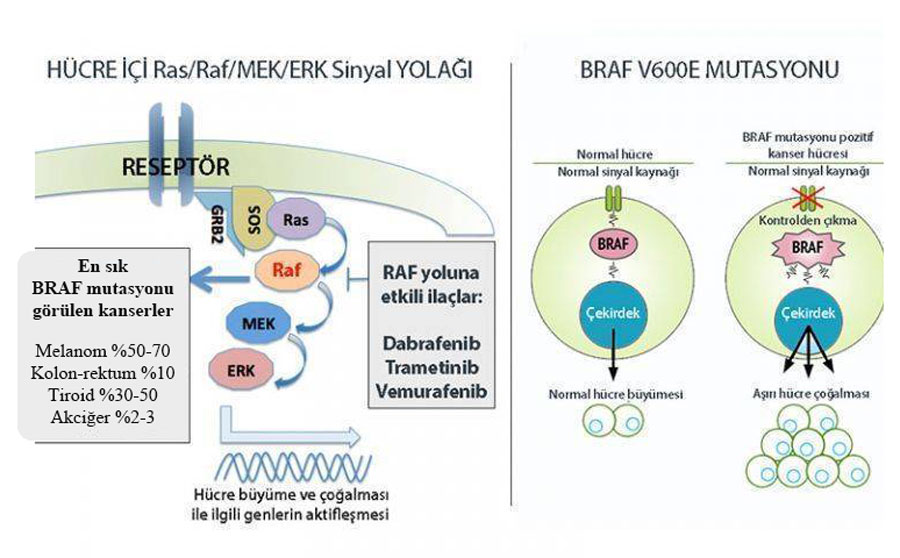
Dabrafenib, BRAF V600 mutasyonlu kanser hücrelerinde MAPK sinyal yolunu inhibe ederek hücre çoğalmasını engelleyen oral olarak alınan bir kinaz inhibitörüdür.
BRAF İnhibitörü Nedir?
BRAF inhibitörleri, kanser hücrelerinde büyüme sinyallerini ileten BRAF proteinini hedef alan ilaçlardır. Bu inhibitörler, mutasyona uğramış BRAF proteinini inhibe ederek hücre bölünmesini durdurur ve kanser hücrelerinin ölümünü sağlar.
Etki Mekanizması Nasıldır?
- Dabrafenib, mutant BRAF serin-treonin kinaz enzimini, özellikle BRAF V600E mutasyonunu hedef alır ve bu enzimin aktivitesini inhibe eder.
- Mitogenle aktive olan protein kinaz (MAPK) sinyallemesini engelleyerek hücre büyümesini durdurur.
- Wild-type BRAF ve CRAF kinazlarını inhibe etme özelliği gösterir, ancak bu inhibitör aktivite wild-type BRAF için sınırlıdır.
Dabrafenib, bu mekanizmaları sayesinde kanser hücrelerinin büyümesini engeller ve hastalığın ilerlemesini yavaşlatır.
FDA (ABD Gıda ve İlaç İdaresi) Onay Tarihçesi
- 29 Mayıs 2013: FDA, ileri evre melanom tedavisinde Tafinlar (dabrafenib) için onay verdi.
- 9 Ocak 2014: GSK, Mekinist (trametinib) ve Tafinlar (dabrafenib) kombinasyon kullanımında hızlandırılmış FDA onayı aldı.
- 22 Haziran 2017: Novartis’in kombinasyon hedefe yönelik tedavisi Tafinlar + Mekinist, BRAF V600E mutasyonuna sahip metastatik küçük hücreli dışı akciğer kanseri için FDA onayı aldı.
- 30 Nisan 2018: Novartis, BRAF V600 mutasyonuna sahip melanomun adjuvan tedavisinde Tafinlar + Mekinist kombinasyonu için FDA onayı aldı.
- 4 Mayıs 2018: FDA, BRAF pozitif anaplastik tiroid kanseri tedavisinde Tafinlar + Mekinist için onay verdi.
- 23 Haziran 2022: Novartis, BRAF V600E mutasyonu taşıyan tümör-agnostik solid tümörler için Tafinlar + Mekinist kombinasyonu ile ilk FDA onayını aldı.
- 19 Mart 2023: Novartis, BRAF V600E mutasyonuna sahip düşük dereceli gliomaya sahip pediatrik hastalar için Tafinlar + Mekinist kombinasyonu ile FDA onayı aldı.
Türkiye Ruhsatı
Tafinlar'ın ülkemizde T.C. ruhsatlı olduğu durumlar / terapötik endikasyonlar şu şekilde belirtilmiştir:
Terapötik Endikasyonlar:
- TAFİNLAR, daha önce herhangi bir RAF yolağı inhibitörü kullanmamış, ECOG performans skoru 0-1 olan, lokal tedaviler sonrası nüks eden ve tekrar lokal tedavilerin kullanılmadığı relaps veya metastatik BRAF V600 mutasyonu pozitif olan malign melanom hastaların tedavisinde tek ajan olarak veya trametinib ile kombinasyon halinde progresyona kadar kullanımda endikedir.
- TAFİNLAR, trametinib ile kombinasyon halinde BRAF V600 E mutasyonlu Evre III melanomu olan yetişkin hastaların, tam rezeksiyonu takiben adjuvan tedavisi için en fazla 12 ay süreyle kullanılır. Bu süre içerisinde progresyon gelişen hastalarda tedavi kesilir. Tafinlar, tek başına kullanılamaz.
- BRAF V600 E mutasyonu akredite laboratuvarda saptanmış olup EGFR veya ALK mutasyonu olmayan veya bilinmeyen, ECOG performans durumu 0-1, kemik iliği rezervi yeterli olan (nötrofil sayısı 1500, trombosit sayısı 100000 üzerinde olan), karaciğer ve renal fonksiyonları yeterli olan (ALT, AST, bilirubin ve serum kreatinin normalin en fazla 1,5 katı olan) lokal ileri veya metastatik akciğer adenokanserli hastaların sol ventrikül ejeksiyon fraksiyonu normal sınırlarda olması durumunda trametinib ile birlikte progresyona kadar kullanımında endikedir. Tafinlar, tek başına kullanılamaz.
Tafinların Geri Ödemesi Var mı?
Tafinlar’ın Sosyal Güvenlik Kurumu (SGK) tarafından geri ödeme kapsamına alındığı tedavi durumları şu şekildedir:
- Daha önce herhangi bir RAF yolağı inhibitörü kullanmamış, ECOG performans skoru 0-1 olan, lokal tedaviler sonrası nüks eden ve tekrar lokal tedavilerin kullanılmadığı relaps veya metastatik BRAF V600 mutasyonu pozitif olan malign melanom hastaların tedavisinde kullanılması durumunda geri ödeme kapsamındadır.
- BRAF V600 E mutasyonlu Evre III melanomu olan yetişkin hastaların, tam rezeksiyonu takiben adjuvan tedavisi için en fazla 12 ay süreyle kullanılması halinde SGK tarafından karşılanır.
TİTCK Ek Onayı Alınmadan Kullanılabilecek Endikasyon Dışı İlaç Listesi İçinde Tafinlar için Durum Nedir?
- EVRE IV KOLOREKTAL KANSER:
BRAF-V600E pozitifliği durumunda setuksimab veya panitumumab ile birlikte 2. basamak ve sonrasında dabrafenib trametinib kullanımı uygundur. - GBM:
BRAF-V600E mutasyonu pozitif olan krt ve temozolamid sonrasında progresyon gösteren hastalarda kullanımı uygundur. - EVRE IV SAFRA YOLLARI KANSERİ:
BRAF-V600E mutasyonu varlığında 2. basamak ve sonrasında kullanımı uygundur.
Direnç Mekanizması
- MAPK sinyallemesinde artış: Kanser hücrelerinde MAPK sinyal yolunun aşırı çalışması, Dabrafenib’e karşı direncin gelişmesine neden olabilir.
- Gen mutasyonları: MEK1 kinazını kodlayan MAP2K1 geninde ve MEK2 kinazını kodlayan MAP2K2 geninde meydana gelen mutasyonlar, hücre içindeki MAPK sinyalini BRAF proteininden bağımsız şekilde aktif hale getirir ve ilacın etkisini azaltır.
- BRAF amplifikasyonu: Kanser hücrelerinde BRAF geninin fazladan kopyalarının bulunması (amplifikasyon), ilacın etkinliğini düşürebilir.
- NRAS mutasyonları: NRAS genindeki değişiklikler, kanser hücrelerinin Dabrafenib'e karşı direnç kazanmasına katkıda bulunabilir.
- Alternatif sinyal yollarının aktivasyonu: Fibroblast büyüme faktörü reseptörü (FGFR), epidermal büyüme faktörü reseptörü (EGFR) ve PI3K/Akt gibi diğer sinyal yollarının devreye girmesi, kanser hücrelerinin Dabrafenib’den kaçmasına yol açabilir.
- Ras/Raf sinyal yolunun yeniden aktivasyonu: Kanser hücrelerinde Ras ve Raf sinyal yollarının yeniden aktif hale gelmesi, ilacın etkisini azaltarak direncin gelişmesine sebep olabilir.
Emilim
Ağız yoluyla biyoyararlanımı yaklaşık %95’tir. Emilim hızlıdır ve 2 saat içinde plazma zirve konsantrasyonlarına ulaşır. Yağ oranı yüksek besinler, hem maksimum konsantrasyonu (Cmax) hem de eğri altındaki alanı (AUC) azaltır.
Dağılım
Dabrafenib, plazma proteinlerine %99’dan fazla oranda bağlanır.
Metabolizma
Dabrafenib, başlıca karaciğerde CYP2C8 ve CYP3A4 mikrozomal enzimleri tarafından metabolize edilir ve hidroksi-dabrafenib metabolitini oluşturur. Bu metabolit, daha sonra CYP3A4 enzimi ile karboksi-dabrafenib metabolitine dönüştürülür. Hidroksi metabolit ve diğer metabolitler de klinik olarak aktif olabilir. Dabrafenib'in eliminasyonu esas olarak karaciğer yoluyla olur; yaklaşık %70 dışkı ile ve %25 ise böbrekler yoluyla idrarla atılır. Dabrafenib'in ortalama terminal yarı ömrü yaklaşık 8 saattir.
Doz Aralığı
- Yetişkin hastalarda tek ajan olarak veya kombinasyon halinde önerilen doz 150 mg ağız yoluyla, günde iki kez (bid) alınır. Yemeklerden en az 1 saat önce veya 2 saat sonra alınmalıdır.
- Pediatrik hastalar için önerilen doz, vücut ağırlığına göre ayarlanarak ürün prospektüsünde belirtilmiştir.
İlaç Etkileşimleri
- Ketokonazol, itrakonazol, eritromisin gibi ilaçlar, dabrafenibin metabolizmasını azaltarak ilaç seviyelerini ve potansiyel toksisiteyi artırabilir.
- Rifampin, fenitoin gibi ilaçlar, dabrafenib metabolizmasını artırarak ilaç etkinliğini azaltabilir.
- Dabrafenib, warfarinin antikoagülan etkisini artırabilir; PT ve INR düzenli kontrol edilmelidir.
Dikkat Edilmesi Gereken Durumlar
- Deri kanseri riski nedeniyle başlangıçta ve tedavi süresince her 2 ayda bir cilt muayenesi yapılmalı, tedavi sonlandıktan sonra da 6 aya kadar bu muayeneler devam etmelidir.
- Dabrafenib'in ateşli ilaç reaksiyonlarına yol açabileceği için, vücut ısısı izlenmeli ve 38,5°C’den yüksek ateş durumunda ilaç kesilmeli, enfeksiyon riski değerlendirilmelidir.
- Diyabet veya hiperglisemisi olan hastalarda serum glukoz seviyeleri düzenli olarak izlenmelidir.
- Göz reaksiyonları riskine karşı hastalar üveit, irit gibi durumlar için göz muayenesine tabi tutulmalıdır.
- BRAF-V600E mutasyonunun varlığı, tedaviye başlamadan önce FDA onaylı bir tanı testi ile doğrulanmalıdır.
- Hafif karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmez. Orta veya şiddetli karaciğer yetmezliği olan hastalarda dikkatli olunmalıdır.
- Hafif ve orta düzeyde böbrek yetmezliği olan hastalarda doz ayarlaması gerekmemektedir, ancak şiddetli böbrek yetmezliği olan hastalarda dikkat edilmelidir.
- Tedavi sırasında Seville portakalı, greyfurt, pomelo, yıldız meyvesi gibi turunçgillerin ve ürünlerinin tüketiminden kaçınılmalıdır.
- Dabrafenib, fetüs üzerinde zararlı etkilere sahip olabilir. Üreme potansiyeli olan kadınlar, tedavi süresince ve son dozdan sonra belirli bir süre boyunca etkili bir doğum kontrol yöntemi kullanmalıdır (tek başına kullanıldığında en az 2 hafta, trametinib ile kombinasyon halinde kullanıldığında en az 4 ay).
Yan Etkiler
En sık olandan en seyrek olana göre yan etkiler şu şekilde bildirilmiştir:
- Cilt hücre kanserleri (skuamöz hücreli kanserler ve keratoakanthoma), genellikle tedavi başlangıcından 6-8 hafta sonra görülür.
- Cilt reaksiyonları, hiperkeratoz, el-ayak sendromu, döküntü.
- Ateş.
- Hiperglisemi.
- Eklem ağrıları (artralji) ve kas ağrıları (miyalji).
- Oftalmolojik yan etkiler (üveit, irit, fotofobi).
- Kabızlık.
- Yorgunluk.






