Kontrol ALT ile kanseri silmek
Yaş, kanser için en büyük risk faktörüdür ve dünya nüfusunun ortalama yaşam süresi artmaya devam ettikçe, kanser sıklığının çarpıcı bir biçimde artması da beklenmektedir. Ulusal Sağlık Enstitüleri ve Dünya Sağlık Örgütü tarafından yayınlanan 2011 tarihli Küresel Sağlık ve Yaşlanma Raporu, 2050 yılına kadar 65 yaş ve üzeri kişi sayısının üç katına çıkarak 1,5 milyara ve yıllık yeni kanser vaka sayısının da 2030 yılına kadar 27 milyona ulaşacağını öngörmektedir. Şüphesiz ki yaşlanan küresel nüfus ile ilişkili zayıflık ve hastalıkları hafifletmek, ekonomik ve insan kaynaklı felaketlerden kaçınmak için yeni antikanser yaklaşımlarının geliştirilmesini gerektirecektir.
Telomerlerin alternatif uzaması (alternative lengthening of telomeres= ALT) yolağını kapatarak kanseri tedavi etmek
Hücresel ölümsüzlük, normal dokudan kanserli dokuları ayırt etmeye yarayan bir özelliktir. Normal bir somatik (vücut) hücre her bölündüğünde, telomer adı verilen kromozomların uçlarındaki DNA kısalır. Telomer çok kısaldığında – ki bu 30-50 bölünme sonrası olur – bir alarm sinyali üretilir ve hücre bölünmeyi kalıcı olarak durdurur. Daha sonra yaşlanmaya girer veya apoptoza başlar.
Kanser hücresinin telomerin kısalmasını engelleyen mekanizmaları
Hücre her bölündüğünde telomerlerin kısalması, hücresel yaşam süresini sınırlamak için biyolojik bir mekanizma görevi görür. Öte yandan kanser hücreleri, telomeraz enzimini kullanan bir RNA şablonundan veya telomerlerin alternatif uzaması (ALT) olarak isimlendirilen bir mekanizma kullanan DNA şablonundan yeni telomerik DNA sentezleyerek telomer bakım mekanizmasını (TMM) aktive eder ve ölümsüzleşebilir.
Not: Elizabeth H. Blackburn, Carol W.Greider ve Jack W. Szostak adlı bilim insanları, kromozomların telomer ve telomeraz tarafından nasıl korunduklarını keşfetmeleri sebebiyle 2009 yılı Nobel Tıp ve Fizyoloji Ödülü’ne layık görülmüşlerdir.
Bir telomer bakım mekanizmasının varlığı, kanser hücrelerinin neredeyse genel bir özelliği olduğu için ve bu mekanizmaları deneysel olarak baskılamak, kanser hücresi yaşlanması veya ölümü ile sonuçlandığı için, telomer bakım mekanizmaları kanser tedavisinde kullanışlı hedefler olabilir. Gerçeği söylemek gerekirse iyi tanımlanmış telomeraz bazlı yolağı hedefleyen birkaç tedavi, klinik araştırmaların ileri aşamalarındadır. Ancak şu anda aktif kullanımda olan ALT hedefli ilaçlar yoktur, çünkü bu süreç henüz daha net anlaşılmamıştır.
ALT destekli kanserler
Sağlıklı doku ve organların kök hücrelerinde meydana gelen telomer uzamasının aksine ALT aktivitesi, normalde sağlıklı kişilerde doğum sonrası dokularda bulunmaz. Her yıl, kanserlerin %10’unun hücresel ölümsüzlüğü sağlamak için bir ALT stratejisi kullandığına dair bir tahmine dayanan, ALT kanserleri nedeniyle dünya çapında yaklaşık 1,4 milyon yeni vaka ve 820,000 yaşam kaybı vardır. Bunlar, pediatrik ve yetişkin beyin kanserleri, yumuşak doku sarkomu, osteosarkom ve akciğer kanserleri gibi klinik olarak tedavi edilmesi daha zor zor kanserlerden bazılarını içerir. Açık bir şekilde ALT’yi hedeflemek, yeni kanser tedavilerinin geliştirilmesinde çok çekici bir stratejidir.
Ayrıca herhangi bir kanser tedavisinde olduğu gibi kanseri yenmek için telomeraz bazlı stratejilere karşı da direnç geliştirme potansiyeli bulunmaktadır. Birkaç in vitro (laboratuvar) çalışma, insan kanser hücre hatlarının ALT’yi aktive ederek telomer kaybının üstesinden gelebileceğini bildirmektedir. Farelerde telomeraz enziminin baskılanmasınun, telomerler tedavi ile kısaldıkça, mevcut tümörlerin ALT yolağını aktive etmesine neden olduğu da gösterilmiştir. Önemli olarak, bazı insan tümörleri, aynı hücre içinde aynı anda olması gerekmemesine rağmen hem ALT hem de telomeraz aktivitesine sahiptir. Bu nedenle telomeraza bağımlı kanser tedavilerinin, ALT yolağını aktive etmek ve/veya tümör içinde zaten ALT kullanan hücreleri seçmek için tümörlerde seçici baskı oluşturması uygundur, bu da telomer bakım mekanizmalarını hedef alan antikanser yaklaşımların başarısı için ALT’ye özgü tedavilerin geliştirilmesini zorlu kılar.
Telomerlere yakın bakış ve değişen kanser
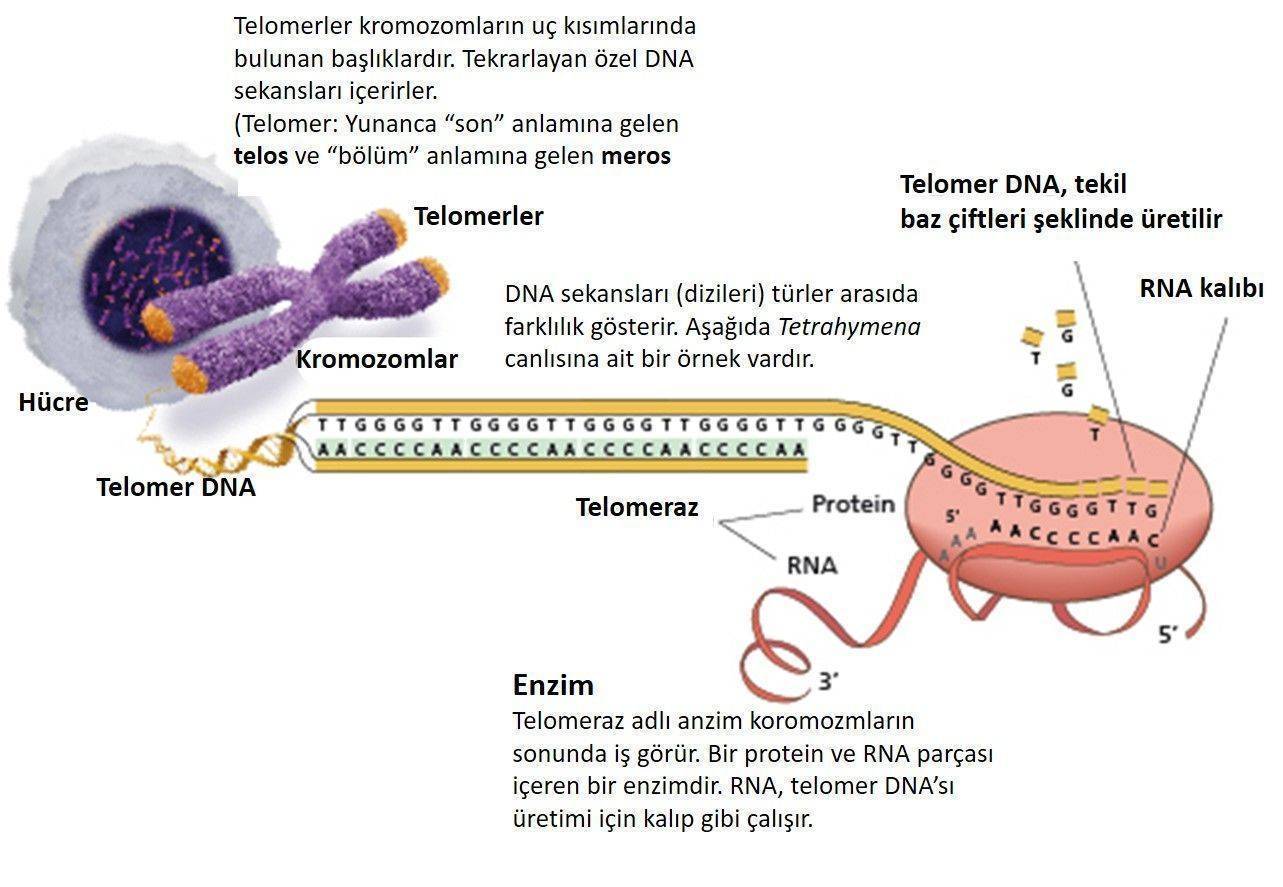
Telomerler, Shelterin Kompleksi olarak bilinen bir grup protein etrafında iç içe geçmiş tekrarlayan hesamerik DN dizilerinden (5’ – TTAGGG – 3’) oluşur. Bu yapılar, her kromozomun ucunda koruyucu bir başlık oluşturur. Tüm telomerler aynı tekrarlayan DNA’yı içerdiğinden, homolog rekombinasyon aracılığıyla telomerik diziyi içeren başka bir molekülün kopyalanmasıyla yeni telomerik DNA üretilebilir.
ALT kanser hücrelerinin ayırt edici özelliklerinden biri, kromozomlardan ayrılan büyük miktarda telomerik tekrar DNA’ları içermeleridir. Lineer veya dairesel olabilen bu ekstra kromozomal diziler, ALT aracılı telomer uzaması için şablon görevi görebilir. Şablon aynı zamanda kendi üzerinde geri dönen kardeş kromatidin sonu gibi başka bir telomer veya aynı telomer olabilir.
ALT aktivasyonu, muhtemelen DNA hasar yanıtına ve homolog rekombinasyon mekanizmasının ALT aktivitesini başlatmasına izin veren telomerlerdeki yeniden protein modelleyen önemli kromatinlerin kaybı ile ilişkilidir. ALT aktivasyonuna ayrıca bazı nükleer proteinlerin telomelerle anormal ilişkisinin yanı sıra mayoz bölünmede kullanılan tekrarlanması eşlik eder. ALT ve ALT benzeri mekanizmalar, mayadan solucanlara ve insanlara evrimsel olarak korunmuş olduğu görünmektedir. Aslında, bazı maya türleri, uçlarında lineer genomlu mitokondri ve telomer benzeri tekrar dizileri içerir. Bu mitokondriyal genomlar, ALT kullanan insan hücrelerinde bulunana benzeyen rekombinasyona dayalı bir mekanizma yoluyla telomerlerini korur. Bu, ALT'nin, bir TMM olarak telomerazın ortaya çıkmasından önce dairesel formdan geçiş yaptıktan sonra lineer genomlarda stabiliteyi korumak için gereklilikten dolayı evrimleştiği olasılığını gündeme getiriyor.
Farelerde yapılan çalışmalar, rekombinasyon aracılı ALT mekanizmasının, embriyonik gelişimin erken aşamalarında gözlenen telomer uzamasının arkasındaki ana etken olduğunu göstermektedir. ALT ile telomer uzaması, murin somatik hücrelerinin uyarılmış pluripotent kök hücrelere yeniden programlanmasında ve somatik hücre nükleer transferi ile embriyonik kök hücrelerin üretilmesinde de rol oynayabilir. Bu nedenle, ALT mekanizmasını harekete geçiren kanserler, ölümsüzleşmeyi sağlamak ve zarar vermek için önemli bir biyolojik fenomenden faydalanıyor olabilir. Bu nedenle, ALT yolağının mekanik olarak daha iyi anlaşılması, yalnızca daha etkili kanser tedavilerine değil, aynı zamanda genomik biyolojik evrimin daha iyi kavranmasına da katkı sağlayabilir.
Ancak, ALT hedefli tedavilerin geliştirilmesi oldukça zordur. Telomeraz yolundan farklı olarak, ALT mekanizmasının bilinen bir spesifik enzim aktivitesi yoktur ve ALT'de rol oynayan bugüne kadar tanımlanmış tüm enzimler de normal hücresel yolaklar için gereklidir. ALT aktivitesinin varlığı, genellikle, uzun ve heterojen telomer uzunluk dağılımları veya ALT ile ilişkili promiyelositik lösemi nükleer cisimleri (APB) gibi telomer ile ilgili fenotiplerin saptanmasından çıkarılmıştır, ki bu aksi takdirde her yerde bulunan nükleer proteinlerden oluşan bir kompleks içinde telomerlerin anormal varlığını gösterir. (“Going Long” The Scientist, Nisan 2014.) Bu belirteçler, bazen yanlış sonuçlar verebildiklerinden ve yüksek verimli uygulamalar veya klinik laboratuvarlar için pratik olmadıklarından dolayı tamamen tatmin edici değildir.
ALT hedefli kanser terapötiklerinin ve teşhisinin geliştirilmesine yönelik önemli bir adım, ilk ALT'ye özgü molekül olan telomerik C-circle’ların keşfiydi (Nat Biotechnol, 27:1181-85, 2009). C-circle’lar, telomerlerden oluşturulan sıra dışı bir dairesel DNA türüdür. Kanser hücrelerindeki C-circle’ların seviyesi, ALT aktivitesinin seviyesini doğru bir şekilde yansıtır ve bu biyobelirteç, ALT aktivitesi pozitif olan kemik kanseri olan hastaların kanında bulunabilir. APB analizindeki gelişmelerin yanı sıra C-circle analizinin geliştirilmesi, yakın gelecekte, ALT yolağının modülatörlerini aramak için sağlam, yüksek verimli taramalar gerçekleştirmeyi mümkün kılabilir, ki bu, bu alandaki keşif hızını büyük ölçüde hızlandıracaktır. Daha fazla araştırma, şüphesiz bu fenomenin mekanik olarak daha eksiksiz bir şekilde anlaşılmasına ve kansere karşı ilk ALT’ye özgü tedavilere yol açacaktır. ALT’yi kontrol etmek, kanser sıkıntısını toplumdan silmeye yardımcı olabilir.
1. SLX4IP promotes RAP1 SUMOylation by PIAS1 to coordinate telomere maintenance through NF-κB and Notch signaling. BY NATHANIEL J. ROBINSON, MASARU MIYAGI, JESSICA A. SCARBOROUGH, JACOB G. SCOTT, DEREK J. TAYLOR, WILLIAM P. SCHIEMANN. SCIENCE SIGNALING 29 JUN 2021. Targeting the binding partners of the telomere protein RAP1 could halt the growth of ALT-proficient tumors.
2. Sliva H. ve ark. (01.04.2015). Control ALT, Delete Cancer. The Scientist: https://www.the-scientist.com/