KRASG12C Mutant Akciğer Kanserinde Adagrasib Yerini Sağlamlaştırdı – ASCO24
KRYSTAL-12 çalışması, daha önce tedavi görmüş ileri evre KRASG12C mutasyonlu küçük hücreli dışı akciğer kanseri (KHDAK) hastalarında adagrasibin, dosetaksele kıyasla progresyonsuz sağkalım (PFS) ve objektif yanıt oranı (ORR) açısından anlamlı bir etkinlik faydası sağladığını ortaya koydu. ASCO 2024'ün ikinci gününün en dikkat çekici sunumu olan bu çalışmanın sonuçları, sınırlı tedavi seçeneklerinin bulunduğu ileri evre KHDAK'li hastalarda adagrasib kullanımını desteklemektedir.
KRAS Nedir?
KRAS'ın insan kanserinde en yüksek oranda mutasyona uğramış onkogenlerden biri olduğu bilinmektedir. KRAS'taki mutasyonlar, RAS/MAPK sinyal kaskadı yoluyla birden fazla kanser türünün büyümesini ve çoğalmasını sağlar.

KRAS mutasyonları bir zamanlar hedeflenemez ve tedavi edilemez olarak kabul ediliyordu, ancak sotorasib etken maddeli Lumakras adlı ilacın, KRAS G12C mutasyonuna uğramış KHDAK'lere karşı etkili olduğu kanıtlandı ve Mayıs 2021'de FDA onayı aldı. Böylelikle sotorasib, onaylanan ilk KRAS hedefli kanser tedavisi oldu.
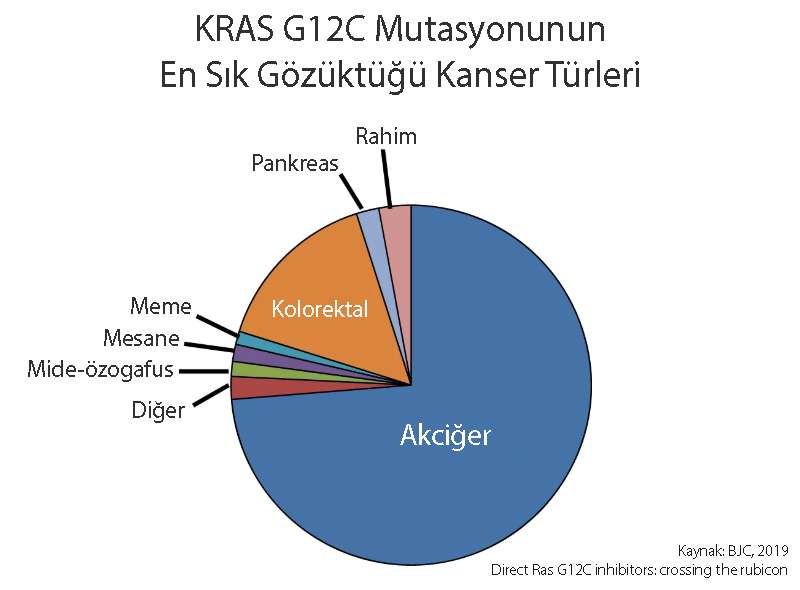
En yaygın KRAS G12 mutasyonları G12D (%36), G12C (%14) ve G12V'dir (%23). KRAS mutasyonlarının şu an için sadece G12C için onaylı bir hedefe yönelik tedavi mevcuttur.
Hızlandırılmış FDA Onayını Pekiştiren Sonuçlar
İleri evre KRAS G12C mutant ve önceden en az bir sistemik tedavi almış olan KHDAK olan yetişkin hastalar için sotorasibden sonra adagrasib (Krazati, Mirati Therapeutics, Inc.) KRYSTAL-1 çalışması ile Aralık 2022'de hızlandırılmış FDA onayı almıştı.
ASCO 2024'ün 2. Gününün En Dikkat Çeken Çalışması: KRYSTAL-12
KRASG12C mutasyonlu, daha önce tedavi görmüş lokal ileri veya metastatik KHDAK hastalarında adagrasib, dosetaksele göre progresyonsuz sağkalım (PFS) ve objektif yanıt oranı (ORR) açısından önemli bir iyileşme sağlamıştır. Bu sonuçlar, 2024 ASCO Yıllık Toplantısı'nda sunulan faz 3 KRYSTAL-12 çalışmasında yer aldı.
Adagrasibin tedavi yanıtları kalıcı görünmekte olup, beyin metastazı olan hastalarda da beyin içi yanıtlar gözlemlenmiştir. Güvenlik sonuçları ise önceki raporlarla tutarlıdır.
KRYSTAL-12 çalışması, adagrasib'in, KRASG12C mutasyonlu hastalar için ikinci basamak tedavi olarak etkinliğini doğrulamakta ve mevcut standart tedaviye göre daha yüksek tümör yanıt oranları ve daha uzun PFS sağladığını göstermektedir.
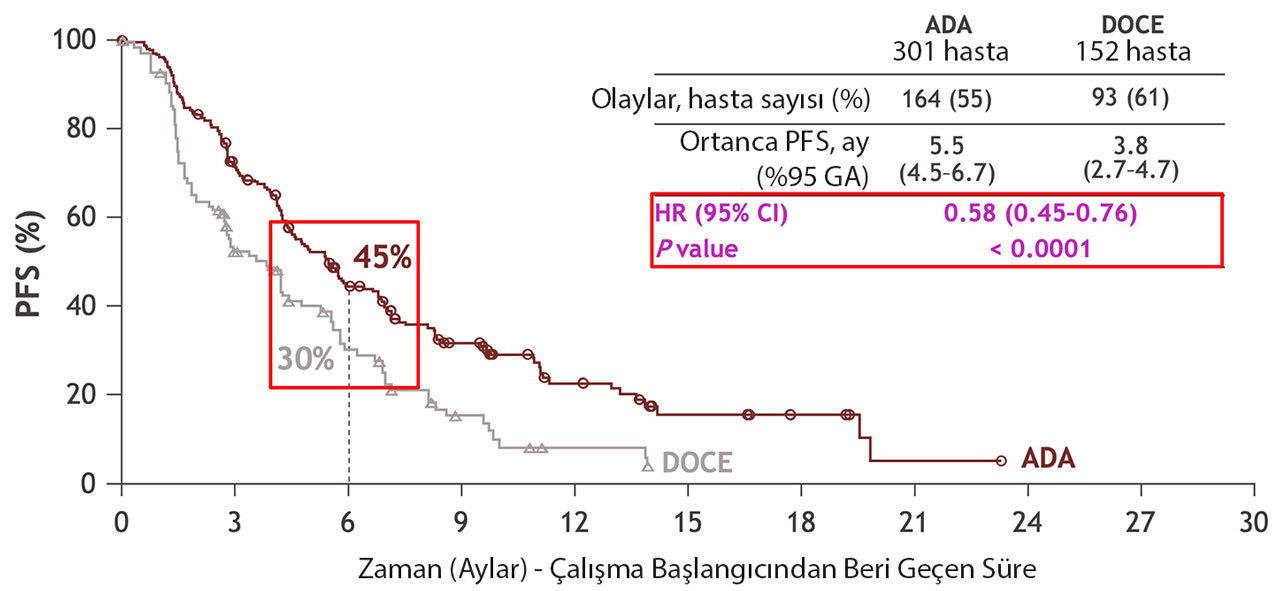
Yukarıdaki grafik, KRYSTAL-12 çalışmasında adagrasib (ADA) ve dosetaksel (DOCE) tedavi gruplarındaki progresyonsuz sağkalım (PFS) sonuçlarını göstermektedir. Grafikteki ana noktalar şunlardır:
-
Yatay Eksen (Months from randomization): Rastgeleleştirmeden itibaren geçen aylar belirtilmiştir. Bu eksen, çalışmanın başlangıcından itibaren geçen zamanı gösterir.
-
Dikey Eksen (PFS %): Progresyonsuz sağkalım yüzdesi gösterilmektedir. Bu eksen, hastaların kanser ilerlemesi veya ölüm olmadan hayatta kalma oranını ifade eder.
-
Kırmızı Çerçeve İçindeki Yüzdeler:
- Adagrasib: 6 ay sonra hastaların %45'i progresyonsuz sağkalım göstermiştir.
- Dosetaksel: 6 ay sonra hastaların %30'u progresyonsuz sağkalım göstermiştir.
-
Eğriler:
- Adagrasib (ADA) Eğrisi: Kırmızı renkte gösterilmiş ve dosetaksel'e kıyasla daha iyi bir sağkalım oranı göstermektedir.
- Dosetaksel (DOCE) Eğrisi: Gri renkte gösterilmiş ve adagrasib'e kıyasla daha düşük bir sağkalım oranı göstermektedir.
-
Medyan PFS Değerleri:
- Adagrasib (ADA): 5.5 ay (4.5-6.7 ay, %95 güven aralığı)
- Dosetaksel (DOCE): 3.8 ay (2.7-4.7 ay, %95 güven aralığı)
-
HR (Hazard Ratio): 0.58 (0.45-0.76, %95 güven aralığı). Bu oran, adagrasib'in dosetaksel'e kıyasla hastalık progresyonu veya ölüm riskini %42 oranında azalttığını göstermektedir.
- P Değeri: < 0.0001, bu sonuçların istatistiksel olarak anlamlı olduğunu göstermektedir.
KRYSTAL-12 çalışmasının temelinde, KRASG12C mutasyonunun hedeflenebilir bir moleküler sürücü onkogen olması yatmaktadır. Bu mutasyon, yıllardır hedef alınmaya çalışılan bir hedef olup, ancak son yıllarda G12'deki küçük cebi yakalayarak hedefe yönelik tedavilerin geliştirilmesine olanak sağlanmıştır.
Mayıs 2021'de, KRASG12C inhibitörü sotorasib, faz 2 CodeBreaK-100 çalışmasında %37 ORR göstermesi üzerine ABD Gıda ve İlaç Dairesi (FDA) tarafından hızlandırılmış onay almıştır. Ancak, faz 3 CodeBreaK-200 çalışmasında sotorasib'in dosetaksel'e kıyasla anlamlı bir PFS faydası göstermesine rağmen, FDA Onkolojik İlaçlar Danışma Komitesi, çalışmanın sınırlamaları nedeniyle sotorasib'in tam onayı için yapılan ek yeni ilaç başvurusunu reddetmiştir. Komite, çalışmanın ve yürütülüşünün, özellikle dosetaksel kolundaki daha yüksek bırakma oranı da dahil olmak üzere, çeşitli sorunları nedeniyle PFS sonucunun güvenilir bir şekilde yorumlanamayacağına karar vermiştir. FDA, tam onay için yeni bir doğrulama çalışmasının Şubat 2028'e kadar tamamlanmasını talep etmektedir.
Adagrasib, Aralık 2022'de faz 1/2 KRYSTAL-1 çalışmasında %43 ORR göstermesi üzerine hızlandırılmış onay almıştır. KRYSTAL-12, bu popülasyonda adagrasib ve dosetaksel'in etkinlik ve güvenliğini karşılaştırmak için yapılan doğrulama faz 3 çalışmasıdır.
Toplamda 453 hasta, daha önce platin bazlı kemoterapi ve anti–PD-L1/PD-1 tedavisi almış lokal ileri veya metastatik KHDAK'li KRASG12C mutasyonu taşıyan hastalar, adagrasib 600 mg günde iki kez oral (301 hasta) veya dosetaksel 75 mg/m2 her 3 haftada bir intravenöz (152 hasta) olacak şekilde rastgele atanmıştır.
Çalışma, kollar arasındaki farkları güvenilir bir şekilde tespit edebilecek verilerin elde edilme olasılığını maksimize etmek için tasarlanmıştır. Öncelikle, çalışma, hedefe yönelik tedaviyi alma şansını artırmak için 2:1 randomizasyon kullanmıştır ve bu durum katılımı artırmıştır. İkinci olarak, doğrulanmış progresyon sonrasında çapraz geçişe izin verilmiştir ve bu durum bırakma oranlarını azaltmıştır.
Çalışmanın ana bulguları arasında, adagrasib'e atanan hastaların %99'unun randomize tedavilerini aldığı, dosetaksel'e atananların ise %92'sinin tedavi aldığı ve dosetaksel kolundaki 44 hastanın (%29) doğrulanmış hastalık progresyonu sonrasında adagrasib'e geçtiği belirtilmiştir.
7.2 aylık medyan takip süresinden sonra, çalışma birincil son noktasına ulaşmış ve adagrasib, dosetaksel'e kıyasla bağımsız kör merkezi inceleme (BICR) ile PFS'de anlamlı bir iyileşme göstermiştir (medyan PFS 5.5 ay vs 3.8 ay; HR 0.58, %95 CI [0.45, 0.76]; P < .0001). Adagrasib'in dosetaksel'e üstünlüğü, kilit alt gruplar arasında da korunmuştur.
BICR ile adagrasib ve dosetaksel için ORR sırasıyla %32 ve %9 olmuştur (odds ratio 4.68, %95 CI [2.56, 8.56]; P < .0001). Yanıt süresinin medyanı sırasıyla 8.3 ay ve 5.4 ay olup, yanıtlar en az 6 ay boyunca sırasıyla %64 ve %39 hastada sürdürülebilmiştir.
Başlangıçta merkezi sinir sistemi metastazı olan hastalar arasında, adagrasib alan hastaların %24'ünde (78 hastadan 19'u) ve dosetaksel alan hastaların %11'inde (36 hastadan 4'ü) beyin içi yanıtlar gözlemlenmiştir. Ayrıca, akciğer kanseri semptom ölçeği (Lung Cancer Symptom Scale) ile adagrasib'e kıyasla dosetaksel'in median zamanına hastaların bildirdiği sonuçlarda anlamlı bir fayda sağlanmıştır (3.0 ay vs 1.5 ay; HR 0.57, %95 CI [0.45, 0.74]).
Güvenlik açısından, adagrasib'in bazı gastrointestinal toksisitelerle ilişkili olduğu belirtilmiştir; adagrasib ile derecesi 1/2 ishal, dosetaksel'e göre daha sık görülmüştür (%48 vs %26), ayrıca derecesi 1/2 kusma (%33 vs %6) ve bulantı (%31 vs %19) da daha sık görülmüştür. Adagrasib ayrıca aspartat aminotransferaz yükselmeleri (%24 vs %0) ve alanin aminotransferaz yükselmeleri (%22 vs %3) ile de ilişkilendirilmiştir.
Adagrasib'in ayrıca dosetaksel'e göre daha sık kreatinin yükselmeleri ile ilişkili olduğu belirtilmiştir (%19 vs %1), ancak bu yükselmelerin gerçek bir böbrek fonksiyon bozukluğu mu yoksa başka nedenlerden mi kaynaklandığı henüz bilinmemektedir.
Gelecekteki adımlar olarak, faz 3 KRYSTAL-7 çalışması (NCT04613596) ileri KRASG12C mutasyonlu KHDAK ve PD-L1 tümör orantı skoru ≥ %50 olan hastalarda adagrasib artı pembrolizumab'ın, tek başına pembrolizumab'a kıyasla etkinliğini karşılaştıracaktır.
Daha yeni ve daha güçlü KRASG12C inhibitörlerinin, örneğin divarasib'in, potansiyel olarak daha üstün yanıt oranları ve tedavi süresi sağlayabileceği düşünülmektedir. Tüm gözler, şu anda devam etmekte olan KRASG12C inhibitörü kombinasyon stratejileri üzerindeki çalışmalara çevrilmiş durumda ve bu çalışmalar, yakında KRASG12C inhibitör monoterapi yaklaşımlarının yerini alabilir.
Özetle, KRYSTAL-12 çalışması, KRASG12C mutasyonlu ileri evre küçük hücreli dışı akciğer kanseri (KHDAK) hastalarında adagrasib'in, dosetaksel'e kıyasla progresyonsuz sağkalım (PFS) ve objektif yanıt oranı (ORR) açısından önemli faydalar sağladığını göstermektedir. Bu bulgular, adagrasib'in, sınırlı tedavi seçeneklerinin bulunduğu ileri evre tedavilerde umut verici bir seçenek olduğunu ortaya koymaktadır.
1. Jänne PA, Riely GJ, Gadgeel SM, et al. Adagrasib in non-small-cell lung cancer harboring a KRASG12C mutation. N Engl J Med. 2022;387(2):120-131.
2. U.S. Food and Drug Administration. FDA grants accelerated approval to sotorasib for KRAS G12C mutated NSCLC. Accessed May 18, 2024.
3. Skoulidis F, Li BT, Dy GK, et al. Sotorasib for lung cancers with KRAS p.G12C mutation. N Engl J Med. 2021;384(25):2371-2381.
4. de Langen AJ, Johnson ML, Mazieres J, et al. Sotorasib versus docetaxel for previously treated non-small-cell lung cancer with KRASG12C mutation: a randomised, open-label, phase 3 trial. Lancet. 2023;401(10378):733-746.
Amgen. Amgen provides regulatory update on status of Lumakras® (sotorasib). Accessed May 20, 2024.
5. U.S. Food and Drug Administration. FDA grants accelerated approval to adagrasib for KRAS G12C-mutated NSCLC. Accessed May 18, 2024.
6. Sacher A, LoRusso P, Patel MR, et al. Single-agent divarasib (GDC-6036) in solid tumors with a KRAS G12C mutation. N Engl J Med. 2023;389(8):710-721.