Melanom Tedavisinde mRNA Aşısı ve İmmünoterapi Kombinasyonu ile Heyecan Verici Sonuçlar
Covid-19 Pandemisi ile tüm dünyanın haberdar olduğu mRNA aşıları, aslında 2010'lu yıllarında başından beri kanser tedavisinde aktif olarak incelenmektedir. Bu dönemde, bilim insanları mRNA teknolojisinin potansiyelini anlamaya başlamış ve kanser tedavisi için bu yöntemi kullanma fikrini geliştirmeye yönelmişlerdir. Ancak, mRNA kanser aşıları üzerine yapılan araştırmaların sayısı ve başarısı, son birkaç yılda, özellikle de COVID-19 pandemisi sırasında ve sonrasında, önemli ölçüde artmıştır.
mRNA Kanser Aşıları Etki Mekanizması Nedir?
mRNA kanser aşılarının temel çalışma prensibi, bağışıklık sistemini kanser hücrelerine karşı özelleştirilmiş bir yanıt geliştirmeye yönlendirmektir. Bu aşılar, kanser hücrelerinde bulunan ve normal hücrelerde bulunmayan özgün proteinleri (neoantijenler) hedeflemeyi amaçlar. İşte mRNA kanser aşılarının temel adımları:
-
Tümör örnekleri alınır: Hastadan alınan tümör biyopsisi örnekleri, kanser hücrelerinde bulunan genetik materyali incelemek için kullanılır.
-
Neoantijenler belirlenir: Tümör örneklerindeki genetik materyal incelenir ve hedeflenmesi gereken spesifik neoantijenler belirlenir. Bu neoantijenler, hastaya özgüdür ve her hastanın kanser hücrelerinde farklı olabilir.
-
mRNA dizisi tasarlanır: Belirlenen neoantijenler için mRNA dizileri tasarlanır. Bu mRNA molekülleri, bağışıklık sistemi hücrelerinin (örneğin T hücrelerinin) kanser hücrelerini tanıması ve hedeflemesi için gerekli bilgiyi taşır.
-
Aşı üretimi: Tasarlanan mRNA dizileri, nano-partiküllerle birleştirilerek aşı olarak üretilir. Bu nano-partiküller, mRNA'nın hücrelere güvenli bir şekilde teslim edilmesine yardımcı olur.
-
Aşı uygulanır: Hazırlanan mRNA kanser aşısı, hastaya enjekte edilir. Bu aşı, bağışıklık sistemi hücrelerinin kanser hücrelerinde bulunan spesifik neoantijenleri tanımasına ve bu hücrelere yönelik bir yanıt geliştirmesine yardımcı olur.
-
Bağışıklık yanıtı: Bağışıklık sistemi, aşı sayesinde öğrendiği bu spesifik neoantijenlere karşı bir yanıt geliştirir. Bu yanıt, kanser hücrelerini hedefleyen ve yok eden T hücrelerinin aktivasyonunu içerir.
Sonuç olarak, mRNA kanser aşıları, bağışıklık sistemini hastaya özgü kanser hücrelerini tanımaya ve hedeflemeye yönlendirerek, kansere karşı etkili bir tedavi sağlamayı amaçlar.
Moderna'nın Kanser Aşısı
mRNA-4157/V940, Moderna tarafından geliştirilen bir kanser aşısıdır. Bu aşı, bir hastanın tümörünün benzersiz mutasyon imzasına dayalı olarak tasarlanmış ve üretilmiş tek bir sentetik mRNA kodundan oluşur ve en fazla 34 neoantijen içerir. Bu aşı, Keytruda (pembrolizumab) immünoterapisi ile birlikte kullanıldığında, tam rezeksiyon (cerrahi olarak çıkarma) sonrası yüksek riskli melanom hastalarının adjuvan tedavisi için FDA (ABD Gıda ve İlaç İdaresi) tarafından Breakthrough Therapy Designation (Çığır Açan Tedavi Tasarımı) almıştır.
KEYNOTE-942 Çalışması
KEYNOTE-942 çalışmasının son verilerine göre, "yüksek riskli melanom" hastaları için hastaya özgü mRNA bazlı kanser aşısı (mRNA-4157/V940, Moderna) ve bağışıklık kontrol noktası inhibitörü pembrolizumab kombinasyonu, yalnızca pembrolizumab ile karşılaştırıldığında nükssüz (tekrarsız) sağkalımı önemli ölçüde arttırdı.
Bu tekrarsız sağkalım faydası, kişiselleştirilmiş aşı ve pembrolizumab alan hastalarda kanserin tekrarlama veya yaşam kaybı riskinin %44 oranında azalması ile ilişkilendirildi.
Bu randomize faz 2b çalışması, randomize bir çalışmada kanser aşısı için pozitif sonuç gösteren ilk çalışmadır. Araştırmacılara göre bu yöntem, diğer çalışmalarda doğrulandığı takdirde, immünoterapi duyarlı diğer solid (doku ve organ kaynaklı) tümörlerin tedavisinde umut vadetmektedir.
16 Nisan 2023'te sunulan bu çalışma, Amerikan Kanser Araştırmaları Derneği (AACR) yıllık toplantısının en dikkat çekici sunumu oldu.
Bu strateji, özellikle küçük hücreli olmayan akciğer kanseri, böbrek kanseri, karaciğer kanseri ve mide-yemek borusu kanseri gibi diğer immünojenik kanserlerde de etkili olabilir.
Özellikle daha önceki kanser aşı çalışmalarının mütevazi sonuçları göz önüne alındığında, bu sonuçların "heyecan verici" olduğu rahatlıkla söylenebilir. Şu ana kadar kanser aşıları hayal kırıklığı yaratmış ve onkolojide anlamlı bir etki yaratmamıştı.
mRNA aşısı, bireyselleştirilmiş olarak hazırlanır ve 34'e kadar hastaya özgü tümör neoantijenlerini kodlar. Aynı zamanda bağışıklık yanıtını güçlendirir.
KEYNOTE-942 çalışmasında, araştırmacılar tamamen çıkarılmış yüksek riskli cilt melanomu olan hastaları 2:1 oranında, toplam 9 doz alacak şekilde her 3 haftada bir intramüsküler enjeksiyon ile mRNA-4157 ve her 3 haftada 18 siklus boyunca intravenöz pembrolizumab alacak şekilde (107 hastada) veya yalnızca pembrolizumab alacak şekilde (50 hastada) rastgele atadılar. Kombinasyon grubundaki ortalama takip süresi 101 hafta, pembrolizumab grubundaki ise 105 hafta idi.
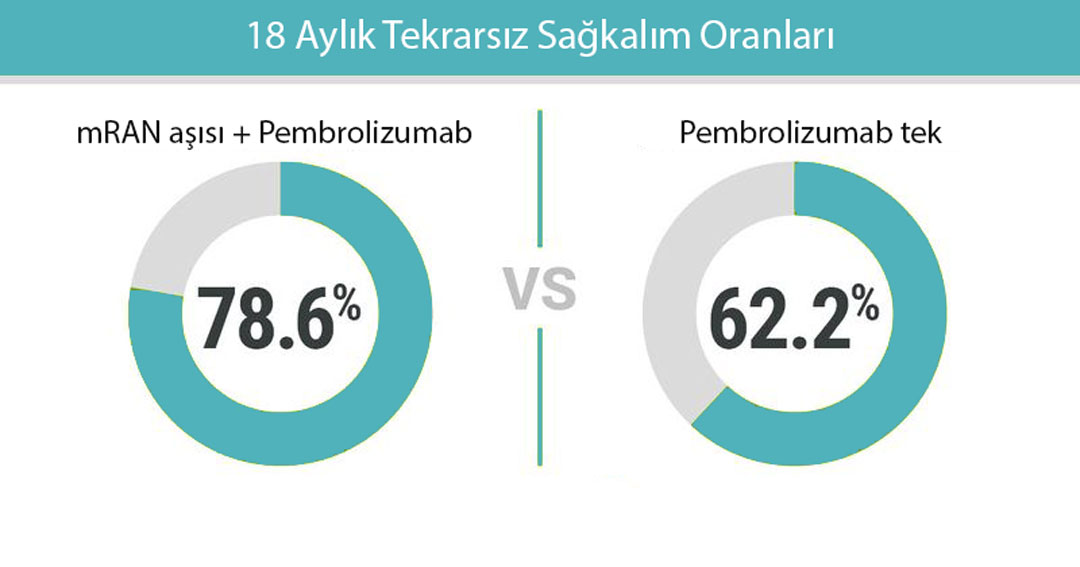
Genel olarak, 18 aylık tekrarsız sağkalım oranları kombinasyon kolunda %78,6 ve pembrolizumab kolunda %62,2 idi. Tekrarsız sağkalım oranları, kişiselleştirilmiş aşı ve pembrolizumab alan hastalarda yalnızca pembrolizumab alanlara kıyasla kanserin tekrarlama veya yaşam kaybı riskini %44 azalttığını gösterdi (tekrarlama için tehlike oranı [HR], 0,561; P = .0266).
Kombinasyon grubundaki hastaların %25'inde ve pembrolizumab grubundaki hastaların %18'inde 3. derece veya daha yüksek yan etkiler meydana geldi. Aşı ile ilişkili en yaygın 3. derece olay yorgunluk idi. Aşı ile ilişkili 4. derece yan etkiler veya yaşam kaybı bildirilmemiş olup, aşının pembrolizumaba eklenmesi bağışıklık aracılı yan etki sıklığını artırmamıştır.
Alt-grup analizinde yüksek tümör mutasyon yükünün, daha fazla hedeflenecek neoantijen anlamına geldiği görüldü, ki bu, kişiye özel neoantijen aşıları geliştirirken faydalıdır. Araştırmacılar, tümör biyopsisi örneklerinin tam ekzom ve tam transkriptom dizilimini yaparak tümörlerin mutasyon yükünü belirlediler.
Yüksek tümör mutasyon yükü, megabaz başına 10 veya daha fazla mutasyon olarak tanımladı.
Genel olarak hem yüksek tümör mutasyon yüküne (HR, 0.642; %95 CI, 0.284 - 1.494) hem de düşük tümör mutasyon yüküne sahip hastalarda (HR, 0.586; %95 CI, 0.243 - 1.415) kombinasyon tedavisi daha etkili oldu.
Yazarlar, aynı durumun yüksek ve düşük tümör iltihaplanma puanına, ayırca PD-L1 pozitif ve negatif hastalar için geçerli olduğunu vurduları. Bu da kombinasyonun tüm hasta alt gruplarında benzer şekilde etkili olduğunu düşündüren bir durumdur.
Sonuç olarak, KEYNOTE-942 çalışmasının elde ettiği olumlu sonuçlar, mRNA kanser aşılarına dair umutları artırmaktadır. Özellikle, Moderna'nın geliştirdiği mRNA-4157/V940 aşısı ve pembrolizumab kombinasyonu, yüksek riskli melanom hastaları için tekrarsız sağkalımı önemli ölçüde iyileştirdiğini göstermektedir. Bu çalışma, kanser aşıları alanındaki başarısız klinik denemelerin ardından elde edilen umut verici sonuçlarla, hem melanom hastaları için hem de kanser aşıları geliştirmeye adanmış bilim insanları için önemli bir adım teşkil etmektedir. İleride yapılacak daha fazla çalışma ile bu başarının diğer kanser türlerine uyarlanması ve geniş bir hasta grubu için etkili bir tedavi stratejisi oluşturulması hedeflenmektedir. Bu gelişmeler, kanser tedavisinde bireyselleştirilmiş ve etkili bir yaklaşım sunarak, hastaların yaşam kalitesini ve sağkalım oranlarını artırabilecektir.
1. American Association for Cancer Research (AACR) Annual Meeting 2023: Abstract CT001. Presented April 16, 2023.
2. 'Exciting' Results for Cancer Vaccine Plus Pembro in Melanoma - Medscape - Apr 17, 2023.