4. evre küçük hücreli dışı akciğer kanseri birinci basamak tedavisi için nivolumab artı ipilimumab ve kemoterapi FDA onayı aldı
26 Mayıs 2020'de ADB Gıda ve İlaç İdaresi (FDA), nivolumab (Opdivo) artı ipilimumab (Yervoy) ve 2 döngü platin-bazlı ikili kemoterapi kombinasyonunu, metastatik veya tekrarlayan küçük hücreli dışı akciğer kanseri (KHDAK) olan hastaların birinci basamak tedavisi olarak onayladı. Hastalarda ayrıca epidermal büyüme faktörü reseptörü (EGFR) veya anaplastik lenfoma kinaz (ALK) genomik tümör sapmaları olmamalı.
CHECKMATE-9LA çalışması
Bu ikili immünoterapinin etkililiği, metastatik veya tekrarlayan KHDAK hastalarında randomize, açık etiketli bir klinik araştırma olan CHECKMATE-9LA'da araştırıldı. Hastalar, nivolumab artı ipilimumab ve 2 döngü platin-bazlı ikili kemoterapi (361 hasta) veya platin-bazlı ikili kemoterapi kombinasyonunu 4 döngü (358 hasta) alacak şekilde rastgele iki koldan birine atandı.
Çalışma, kemoterapi alan hastalara kıyasla nivolumab artı ipilimumab artı kemoterapi ile tedavi edilen hastalarda genel sağkalımda istatistiksel olarak anlamlı bir fayda olduğunu gösterdi:
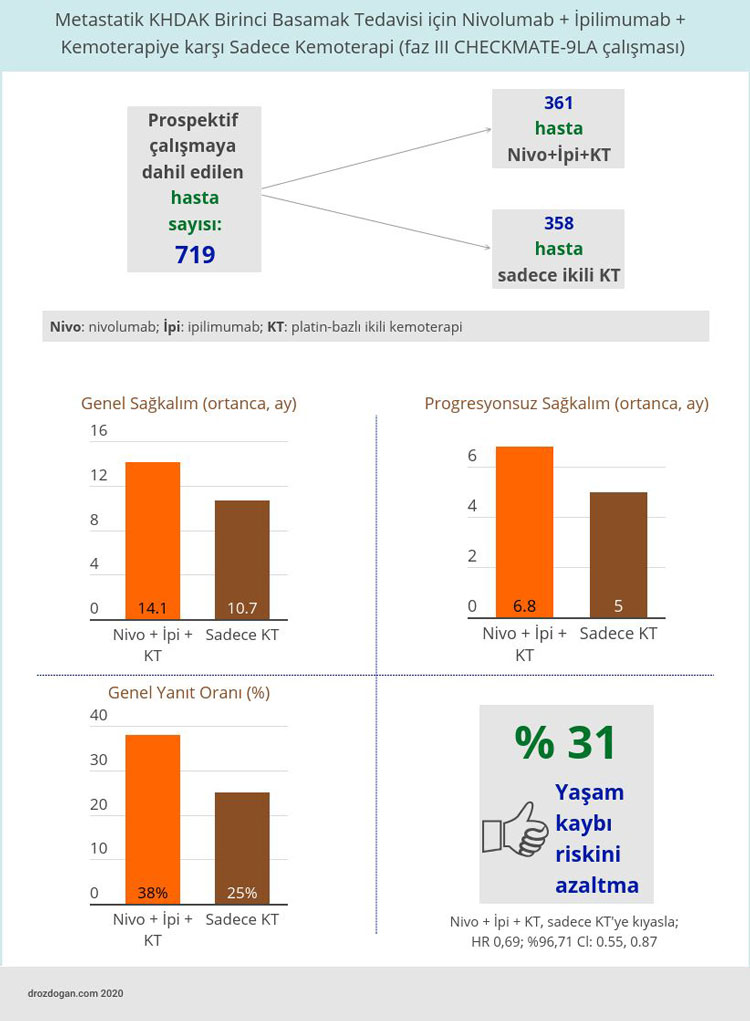
- Ortanca genel sağkalım immünoterapi + kemoterapi kolonda 14.1 ay iken, sadece kemoterapi kolunda 10.7 ay idi.
- Bu grup hastanın birinci basamak tedavisine immünoterapi eklenmesi, yaşam kaybı riskini %31 azalttı (HR 0,69; %96,71 Cl: 0.55, 0.87).
- Kör bağımsız merkezi inceleme merkezi tarafında ölçülen ortanca progresyonsuz sağkalım (PFS), nivolumab artı ipilimumab ve kemoterapi kolunda 6.8 ay iken kemoterapi kolunda 5 ay idi (HR 0.70;% 95 CI: 0.57, 0.86).
- Doğrulanmış genel yanıt oranı sırasıyla %38 ve %25 idi.
- Ortanca yanıt süresi nivolumab artı ipilimumab ve kemoterapi kolunda 10 ay, kemoterapi kolunda 5.1 aydı.
Nivolumab alan hastaların ipilimumab ve platin-ikili kemoterapi ile birlikte en sık (≥% 20'sinde) görülen yan etkiler yorgunluk, kas-iskelet ağrısı, bulantı, ishal, döküntü, iştah azalması, kabızlık ve kaşıntıdır (bakınız immünoterapi yan etkileri).
Bu endikasyon için önerilen nivolumab dozu, 3 haftada bir 360 mg, ipilimumab dozu 6 haftada bir 1 mg / kg ve 2 döngü platin-ikili kemoterapi ile yapılır. Nivolumab ve ipilimumab, hastalık ilerlemesi veya kabul edilemez yan etki olmayan hastalarda 2 yıla kadar devam eder.
FDA approves nivolumab plus ipilimumab and chemotherapy for first-line treatment of metastatic NSCLC.
fda.gov - 26 May 2020






