Biyobenzer ilaç nedir? Önemi ve sıkça sorulan sorular
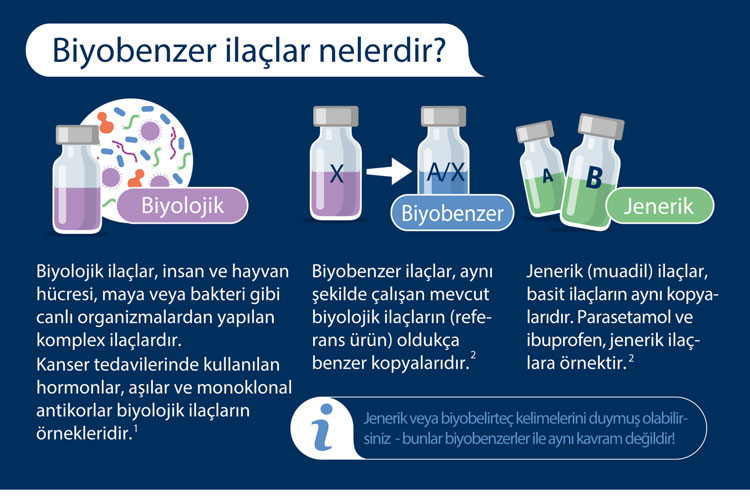
Biyobenzer ilaç nedir?
Biyobenzer ilaç, referans biyolojik ürünlerin patent süresi dolduktan sonra üretilen benzer versiyonlarıdır. Biyolojik ve biyobenzer ilaçlar büyük molekül yapısındandır ve bunların üretiminde kimyasal bileşimler yerine, organizmalar ve canlı sistemler kullanılır. Biyolojik ve biyobenzer ilaçlara en iyi örnek, kanser tedavilerinde de sıkça kullanılan monoklonal antikorlar ve kemoterapiye bağlı lökopeni/nötropeni tedavisinde kullanılan filgrastim veya pegfilgrastim biyobenzerleridir.
Biyobenzerlerin tarihçesi nasıldır?
İlk biyobenzer ABD'de 2015’te FDA onayı aldı. Avrupa’da ise biyobenzerlerin tarihi daha eskiye dayanmaktadır; Avrupa İlaç Ajansı (EMA) ilk kez bir biyobenzere 2006 yılında onay vermiştir ve 2018 itibarı ile Avrupa’da 47 biyobenzer kullanıma girmiştir. Başlangıçta bunların birçoğu onkolojinin destek tedavi tarafında veya endokrinoloji, romatoloji gibi alanlarda iken, 2017 yılından sonra kanser tedavisinde de yoğun kullanımı olan biyolojik ilaçların (bevasizumab ve trastuzumab) biyobenzerleri onay almaya başlamıştır.
2010 yılında dünya genelinde tüm ilaç geliştirme giderlerinin %10’luk kısmı biyobenzerler için ayrılırken, 2015’e gelindiğinde bu oran %15’ye çıkmıştır.
Ülkemizde bu konuda ilgili ilk mevzuat, Biyobenzer Tıbbi Ürünlere İlişkin Kılavuz adı ile 2008 yılında yapıldı. Ülkemizde bir biyobenzer molekül üretildikten sonra ruhsat için başvurur ve değerlendirmeye alınır.
Biyobenzerlerin tanınması, doktorlar ve hastalar için yüksek kaliteli tedavi seçeneklerine erişimin genişlemesine yardımcı olabilir ve ayrıca sağlık sistemi maliyetlerini azaltabilir. Sağlık hizmeti sağlayıcıları, ödeme yapanlar, düzenleyici kurumlar, politikacılar, hasta savunucuları ve hastalar biyobenzerleri daha iyi anlamak ve politika ve kullanım hakkında akıllıca kararlar almak için açık, tarafsız, kanıta dayalı bilgi kaynağına ihtiyaç duyar.
Bu sıkça sorulan sorular (SSS'ler), biyobenzerlerin nasıl geliştirilip üretildikleri, onay ve kullanımla ilgili düzenleyici uygulamalar dahil olmak üzere en sık sorulan soruları cevapları kapsamaktadır.
Biyolojik ilaç nedir?
Biyolojik tedaviler veya "biyolojikler" olarak da bilinen biyolojik ilaçlar, insan, hayvan veya mikroorganizma hücreleri dahil olmak üzere canlı organizmalar tarafından üretilen ilaçlardır. Günümüzde genellikle biyoteknoloji yoluyla üretilmektedirler. Biyolojikler, proteinleri, şekerleri ve nükleik asitleri ve ayrıca gen terapileri gibi canlı varlıkları içerebilir.
Günümüzde mevcut olan ilaçların çoğu, kimyasal olarak sentezlenmiş ilaçlar olan "küçük moleküllü ilaçlar" olarak bilinir. Biyoloji, ilaçların daha küçük bir alt kümesini oluşturur ve genellikle belirli bir hastalığı veya bozukluğu tedavi etmek için doğal süreçleri ve sinyalleri tamamlayarak veya kesintiye uğratarak hastanın vücudunda çalışır.
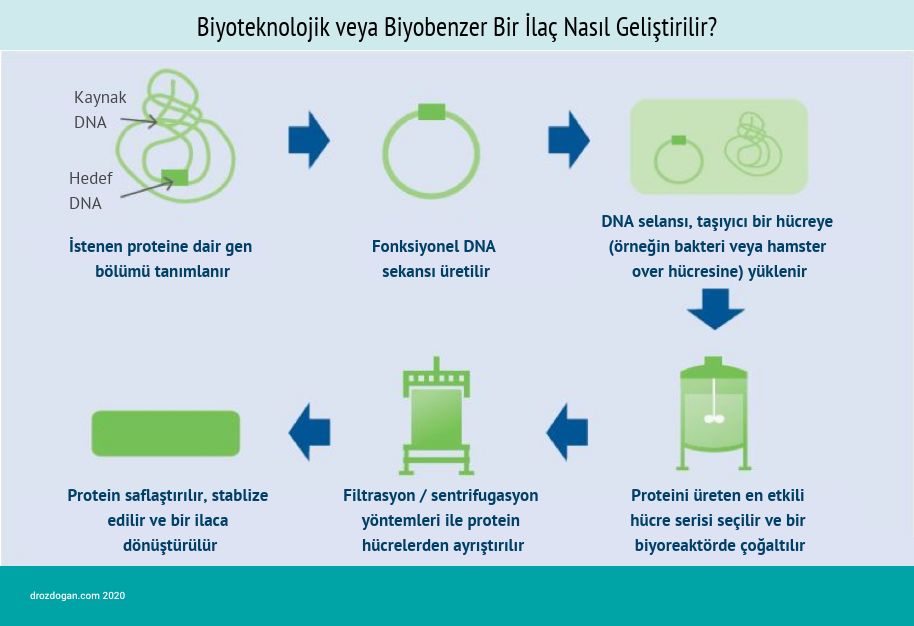
Biyobenzer ilaç nedir?
Biyobenzer bir ilaç, referans ürün olarak bilinen onaylı bir biyolojik ilaca oldukça benzediğini klinik çalışmalarla gösteren biyolojik bir ilaçtır. Bir biyobenzerin, klinik olarak inaktif bileşenlerdeki küçük farklılıklara rağmen referans ürüne oldukça benzer olduğu ve güvenlik, saflık ve etki açısından referans ürünle karşılaştırıldığında klinik olarak anlamlı farklılıklara sahip olmadığı yetkili kurumlar (FDA, EMA, TC: Sağlık Bakanlığı) tarafından belirlenmelidir.
Bazı biyobenzerler, belirli bir zamanda referans biyolojiklerinden neredeyse ayırt edilemez olabilirken, diğerleri, yapı veya biyolojik işlevde haklı olarak bazı farklılıklar gösterebilir. Biyobenzerler oldukça benzer olduğu ve klinik olarak anlamlı farklılıkları olmadığı sürece, biyobenzerlerin kendisi doğal değişkenliğe sahip olan referans biyolojik ile tamamen aynı olması gerekmemektedir.
İlaçların patent süresi ne kadardır?
Patent, bir buluşun değerini korumak için verilen yasal bir haktır ve buluş sahibinin, yaptığı buluşu toplumla paylaşmasını teşvik eder.
İlaç sektöründe patent hakkı, molekülün keşfedilmesinden itibaren 20 yıllık bir koruma sağlar. Ancak, ilaç şirketlerinin, patentli bir molekülü, piyasaya sürülebilir bir ilaca dönüştürmelerinin yaklaşık 12-15 yıl sürdüğü dikkate alındığında, patent korumasından aktif olarak yararlanılan süre 5-8 yıl düşer.
Biyobenzerlerin faydaları nelerdir?
Kanser, anemi ve otoimmün bozukluklar (örn., Multipl skleroz, romatoid artrit, sedef hastalığı ve iltihaplı bağırsak hastalığı) gibi tedavisi en zor hastalıklardan bazıları en iyi biyolojik ilaçlarla tedavi edilir. Pek çok biyolojik tedavi, bir sağlık hizmeti ortamında, enjekte edilebilir bir formda veya intravenöz olarak uygulanacak bir çözelti halinde verilir. Biyolojikler, piyasadaki toplam ilaç sayısının küçük bir yüzdesini oluştururken, yine de önemli bir sağlık hizmeti maliyetini oluşturuyor ve 2014'teki küresel ilaç harcamalarının yüzde 23'ünü temsil ediyor (bu da toplam ABD sağlık hizmetleri harcamasının yüzde 9,3'ü). 1980'lerde doğan bu biyoteknolojik ilaçlar 2014'te 179 milyar dolarlık bir pazara ulaştı. Geliştirilmekte olan birçok yeni ilaç biyolojik olduğundan, bu etkinin artacağı tahmin edilmektedir.
Sağlık hizmeti sunucularına faydaları nelerdir?
Biyobenzer pazarının büyümesi, hastaların bu önemli tedavi seçeneklerine daha hızlı ve daha erken erişimini sağlayabilir. Bu tedaviler, finansal ve idari engellerin azalması nedeniyle hasta erişimini iyileştirme potansiyeline sahiptir.
Biyobenzerlerin hastalara faydaları nelerdir?
Hem biyolojik referans ürün hem de biyobenzerler bir ülkede mevcutsa veya tıbbi olarak birinci basamak tedavide kullanılıyorsa, ilaçların fiyatı düşeceği için daha fazla hasta için bu ilaçların sigorta kapsamına alınması dahil olmak üzere hastalar için bir dizi fayda sağlayabilir (FTC Raporu, Haziran 2009).
Bu durum yüksek biyoteknolojik ilaçlara erişimin artmasına, hastaların belirtilen biyolojik ilaçları alabilmesine ve bu biyolojiklerin hastalara daha erken reçete edilme olasılığının artmasına yol açabilir, bu da daha iyi hasta sonuçlarına yol açar ve bu da sağlık sistemi için önemli tasarruflar sağlar.
Geri ödeme kurumlarına ve sağlık bakım sistemlerine faydası nedir?
Biyobenzerlerin piyasaya sürülmesi, nispeten etkili tedaviler sağlayarak daha fazla tedavi seçeneği ve artan rekabet anlamına gelir. Bu rekabet, düşük fiyatlarla yüksek değerli tedavilere yol açabilir. Biyobenzerlerle elde edilen tasarrufların yeni ilaçların finansmanını sağlayabileceği bilinmektedir.
Biyobenzerler biyolojik referans ürünleriyle aynı şekilde mi çalışır?
Evet. Biyobenzer ve referans ürün arasında güvenlik, saflık ve etkinlik açısından klinik olarak anlamlı farklar yoktur.
Bir biyobenzer, referans ürünü ile yani aynı şekilde çalışacaktır; bir başka deyişle etki mekanizmaları aynıdır.
Onay kurumları, yalnızca aşağıdaki durumlarda biyobenzer onaylayacaktır:
• Biyobenzer olduğu bulunmuştur
• Öngörülen kullanım koşulu veya koşulları için aynı etki mekanizmasını / mekanizmalarını kullanır (referans ürün için bilindikleri ölçüde)
• Kullanım koşulları, referans ürün için önceden onaylanmıştır
• Uygulama yolu, dozaj formu ve biyolojik ürünün gücü referans ürünle aynıdır.
• Biyobenzerin üretildiği, işlendiği, paketlendiği veya tutulduğu tesis, biyolojik ürünün güvenli, saf ve güçlü olmaya devam etmesini sağlamak için tasarlanmış standartları karşılar.
Sonuç olarak biyobenzerler, karşılaştırıldıkları biyolojik referans ürünle aynı şekilde çalışır; biyobenzerlerin güvenlik ve etkililik açısından referans üründen klinik olarak anlamlı bir farkı yoktur.
Biyobenzerler nasıl reçete edilir?
Bir biyobenzer, referans ürün yerine bir doktor tarafından biyobenzerin özel / kutu adı ile reçete edilir. Bir biyobenzer, onay kurumları tarafından değiştirilebilir bir biyolojik olarak onaylandıktan sonra, o ülkede bulunan yasal mevzuat buna izin veriyorsa, reçeteyi yazan hekime önceden bildirimde bulunmaksızın bir eczacı tarafından değiştirilebilir.
Biyobenzerler referans biyolojik ürünlerinin jenerik versiyonları mı?
Hayır. Biyobenzerler jenerik (muadil) ilaçlara benzemez çünkü çoğu jenerik ilaç kimyasal olarak sentezlenirken biyobenzerler canlı sistemler kullanılarak üretilir. Jenerikler, markalı ilaçların kopyalarıdır ve eşdeğer kabul edilir. Bu, aynı aktif bileşene sahip oldukları ve doz formu, güvenlik, güç, uygulama, kalite, performans özellikleri ve kullanım amacı açısından aynı oldukları anlamına gelir. Buna karşılık, biyobenzerler canlı sistemlerden türetilir. Biyobenzerler, klinik olarak inaktif durumdaki küçük farklılıklara rağmen, ilgili referans ürünlerine oldukça benzerdir.
Biyobenzerler nasıl onaylanır?
Bir biyobenzerle ilgili "kanıtların toplamı", halka açık bilgilerin analizi, referans ürünün test edilmesi ve referans ürüne kıyasla biyobenzerin "adım adım" geliştirilmesi yoluyla bir araya getirilir. Kanıtların toplamının herhangi bir potansiyel farklılığı tespit etmek için hem önemli hem de hassas olduğuna ikna olduktan sonra, FDA, EMA veya ülkemizde Sağlık Bakanlığı’na bağlı Türkiye İlaç ve Tıbbi Cihaz Kurumu, biyobenzerin referans ürüne oldukça benzer olmasına dayanarak biyobenzerin bir veya daha fazla kullanım endikasyonunda / hastalıkta kullanılmasını onaylayacaktır.

Ekstrapolasyon nedir?
Bir biyobenzer, referans biyolojik ürününün ruhsatlandırıldığı ancak bire bir klinik karşılaştırması olmayan bir veya daha fazla kullanım koşulu ("endikasyonlar ve kullanım" olarak bilinir) için onaylanabilir. Bu onay, biyobenzerler ile elde edilen verilerin toplamının referans ürünle doğrudan karşılaştırılmasına dayanmaktadır.
Örneğin, bir bevasizumab biyobenzeri olan Zirabev adlı ilaç, küçük hücreli dışı akciğer kanseri (KHDAK) faz III çalışması ile Temmuz 2019’da FDA onayı, Mart 2020’de Türkiye İlaç ve Tıbbi Cihaz Kurumu ruhsatı almıştır. Bununla birlikte Zirabev’in FDA onayı KHDAK dışında kolorektal kanser, beyin tümörü glioblastom, böbrek hücreli kanser ve rahim ağzını kapsamaktadır; ülkemizde de bu biyobenzerin ruhsatı kolorektal kanser, glioblastom ve rahim ağzı kanserini kapsamaktadır.
Onay kurumları, vaka bazında ve endikasyon bazında ekstrapolasyon taleplerini inceler. Ekstrapolasyonun arandığı her gösterge bilimsel olarak gerekçelendirilmelidir. Bilimsel olarak geçerli ekstrapolasyon yoluyla ek bir endikasyonun onaylanması, biyobenzerlerin geliştirilmesini hızlandırır ve gereksiz klinik çalışmaları ortadan kaldırır, böylece hastanın önemli tedavilere erişimini artırır.
Değiştirilebilir ne anlama geliyor?
Değiştirilebilir bir biyolojik, herhangi bir hastadaki referans ürünüyle aynı klinik sonucu üreten bir biyobenzerdir. Bir ürün için kanıtlanmalıdır.
Temelde, bir birey, değiştirilebilir ürünü veya onun referans ürününü kullanarak aynı güvenlik ve etkinlik düzeyini yaşar.
İlgili yasalarca açıklanan ek standartları karşıladığı gösterilen biyolojik bir ürüne atıfta bulunan “interchangeable” (değiştirilebilir) terimi, reçeteyi yazan doktorun müdahalesi olmadan, biyobenzerin referans ürün yerine bir eczacı tarafından ikame edilebileceği veya bunun tersi anlamına gelir.
Otomatik yer değiştirme nedir?
Otomatik yer değiştirme, doktora danışmadan eczane düzeyinde bir ilaç yerine bir başkası verildiğinde gerçekleşir.
Tıpta erken dönem ikame yasaları, jenerik ilaçlara göre yazılmıştır. ABD’de bir eczacının bir ilacı diğeriyle nasıl ve ne zaman ikame edebileceğini açıklayan yasalar eyaletlere göre değişmektedir, Avrupa birliğinde ise bu uygulama biyolojik ilaçlar için tavsiye edilmiyor.
Kanser alanında FDA onaylı biyobenzer ilaçlar (Eylül 2020'ye kadar)
- Zirabev (bevacizumab-bvzr): Haziran 2019: metastatik kolorektal kanser, ileri evre küçük hücre dışı akciğer kanseri, rekürren glioblastom, metastatik renal hücreli kanser ve tedaviye dirençli rekürren veya metastatik serviks kanseri tedavisinde.
- Herzuma (trastuzumab-pkrb): Aralık 2018. HER2 pozitif meme kanseri tedavisi.
- Truxima (rituximab-abbs): Kasım 2018. Yetişkin lenfoma tedavisinde biyobenzer olarak onay alan ilk ilaçtır. anti-CD20 monoklonal antikor olan rituksimab biyobenzeridir.
- Udenyca (pegfilgrastim-cbqv): Kasım 2018. Kemoterapiye bağlı lökopeni / nötropeni tedavisi.
- Nivestym (filgrastim-aafi): Temmuz 2018. Kemoterapiye bağlı lökopeni / nötropeni tedavisi.
- Fulphila (pegfilgrastim-jmdb): Haziran 2018. Kanser tedavisi sırasında enfeksiyon riskini azaltmak için kullanılan Neulasta'nın (pegfilgrastim) FDA tarafından onaylanan ilk biyobenzeridir.
- Retacrit (epoetin alfa-epbx): Mayıs 2018. FDA tarafından anemi (kansızlık) tedavisinde ilk epoetin-alfa biyobenzeridir.
- Ogivri (trastuzumab-dkst): Aralık 2017. FDA tarafından HER2 pozitif meme ve mide kanserlerinin tedavisinde onaylanan ilk biyobenzer ilaçtır (detaylar).
- Mvasi (bevacizumab-awwb): Eylül 2017. Kanser tedavisinde onay alan ilk biyobenzer ilaçtır (detaylar).
- Zarxio (filgrastim-sndz): Mart 2015. FDA tarafından onaylanan ilk biyobenzer ilaçtır. Kanser tedavisi sırasında enfeksiyon riskini azaltmak için kullanılan Neupogen (filgastrim) adlı enjeksiyonun biyobenzeridir.
Türkiye'de bulunan biyobenzer ilaçlar ilaçlar hangileridir?
Ülkemizde bulunan, ruhsat almış ve onkolojide kullanılan biyobenzer ilaçlar şu şekildedir:
- Zirabev (bevasizumab)
- Canhera (trastuzumab)
- Neulastim (pegfilgastrim)
- Lonquex (lipefilgatrim)
Aşağıda, biyobenzerler hakkında hazırladığımız özet infografik poster görülebilir:






Marc Thill, Nicholas Thatcher, Vladimir Hanes & Gary H Lyman. Biosimilars: what the oncologist should know. Future Oncology, 22 Feb 2019.