Yassı Hücreli Cilt Kanseri Tedavisi İçin FDA Onayı Alan İlk İlaç: Cemiplimab
28 Eylül 2018'de ABD Gıda ve İlaç İdaresi (FDA), metastatik, bölgesel olarak ilerlemiş veya cerrahi olarak çıkarılamayan skuamöz (yassı) hücreli cilt kanseri tedavisi için, yeni bir immünoterapi olan cemiplimab (piyasa adı Libtayo) adlı ilaca onay verdi. Cemiplimab, ileri evre yassı hücreli cilt kanseri için FDA onayı alan ilk tedavidir.
Cilt kanserleri, en yaygın görülen kanserlerin başında gelmektedir ve çoğunun metastaz potansiyeli düşüktür. Ayrıca deri kanserleri görünür bir bölgede geliştikleri için sıklıkla erken evrede tespit edilir.
Deri kanserleri, köken aldıkları hücrelere göre genel olarak melanom (deriye rengini veren melanosit adlı hücrelerden köken alan) ve non-melanom (melanom olmayan) olmak üzere ikiye ayrılır ve bu kanserlerin %95 kadarı melanom olmayan türdedir. Melanom olmayan cilt kanserlerinin ise, bazal hücreli kanser ve skuamöz (yassı) hücreli kanser olmak üzere yaygın görülen 2 ana türü vardır. Sıklıklarına göre cilt kanserleri şöyle sıralanır (sıktan seyreğe doğru): bazal hücreli, yassı hücreli ve melanom. Yassı hücreli cilt kanseri, sadece ABD'de her yıl yeni olarak 700 bin kişiyi etkilemektedir. Tüm cilt kanserleri için ana risk faktörü güneş ışınlarıdır.
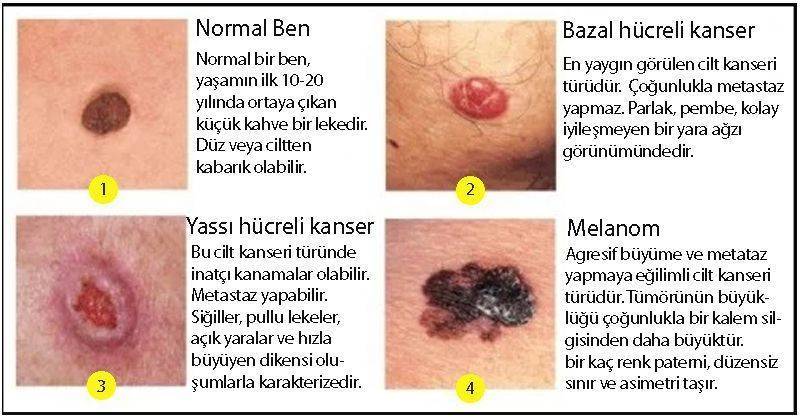
Aşağıdaki şekil: En sık görülen 3 cilt kanseri türü, normal bir ben ve özellikleri:
Melanom-olmayan cilt kanserli hastaların büyük çoğunluğu, kriyoterapi (dondurma), küretaj ve elektrodesikasyon, krem şeklinde uygulanan bölgesel tedaviler (fluorouracil, imikimod) veya ameliyatla çıkarma gibi çeşitli basit yöntemlerle başarıyla tedavi edilebilir. Tümörler daha ilerlemiş olduğunda, daha geniş bir ameliyat veya radyoterapi genellikle bölgesel hastalıkların kontrolü için yeterlidir. Metastaz yapmış (vücuda yayılmış) cilt kanserinde ise tedavi, kanserin bazal hücreli mi yoksa yassı hücreli mi olup olmadığına göre yapılır, fakat tedavi seçenekleri oldukça sınırlıdır.
Bazal hücreli cilt kanserleri çok nadir metastaz yaparken, yassı hücreli cilt kanserlerinin %5 kadarı bölgesel lenf bezlerine ve uzak organlara metastaz yapar.
Özellikle bazal hücreli cilt kanseri bulunduğu yerde tekrarlama eğilimindedir ve ileri evre bazal hücreli kanser için onaylı tek tedavi vardır (sonidegib), ileri evre yassı hücreli cilt kanseri için onaylı bir tedavi şimdiye kadar yoktur.
PD-1'i Bloke Eden Bir İmmünoterapi İlacı Olan Cemiplimaba FDA Onayı Getiren Çalışmanın Detayları
İntravenöz (toplardamar) infüzyon olarak kullanılan Cemiplimab, PD-1 yolunu hedef alan ve böylece vücudun bağışıklık sisteminin kanser hücrelerine karşı savaşmasına yardımcı olan bir immünoterapidir.
Cemiplimab (Libtayo), çeşitli kanserlerin tedavisinde kullanılmak üzere FDA onayı alan 6. farklı PD-1 / PD-L1 hedefli immün kontrol noktası inhibitörüdür. Diğerleri nivolumab (Opdivo), pembrolizumab (Keytruda), atezolizumab (Tecentriq), avelumab (Bavencio), durvalumab (Imfinzi).
Çemiplimabın güvenilirliği ve etkinliği iki açık-etiketli klinik araştırmada değerlendirildi ve etkinlik değerlendirmesine 75'i metastatik ve 33'ü lokal ileri evre yassı hücreli cilt kanseri olan toplam 108 alındı.
Cemiplimab ile tedavi edilen hastaların yaklaşık yarısı (% 47.2) çalışmanın birincil sonlanım noktası olan objektif bir yanıta sahipti. Bu cevapların çoğunluğu veri analizi sırasında devam ediyordu.
Cemiplimab tedavisi sırasında en sık bildirilen immünoterapi yan etkileri cilt alerjileri, yorgunluk ve ishaldir. Diğer immünoterapilerde olduğu gibi, ilaç ciddi veya yaşamı tehdit eden reaksiyonlara neden olabilir. Bunlar arasında, pnömonit, kolit, hepatit ve endokrinopatilerin yanı sıra dermatolojik ve böbrek problemleri de dahil olmak üzere bağışıklık sistemi aracılı yan etki riski bulunmaktadır.
Libtayo, hastalık ilerlemesi veya kabul edilemez yan etkiler ortaya çıkana kadar her üç haftada bir intravenöz (toplardamardan) infüzyon şeklinde uygulanır. Onaylı bir tedavinin bulunmadığı ileri evre yassı hücreli cilt kanseri için bu FDA onayını oldukça anlamlı buluyoruz.
FDA approves first treatment for advanced form of the second most common skin cancer.
fda.gov - 28 September 2018