
EGFR ekson 20 mutasyonlu akciğer kanseri için ilk oral ilaç FDA onayı aldı
Epidermal büyüme faktörü reseptörü (EGFR) ekson 20 insersiyo (ekleme) mutasyonları olan, bölgesel olarak ilerlemiş veya metastatik küçük hücreli dışı akciğer kanseri (KHDAK) olan hastaların tedavisi için mobocertinib (Exkivity, Takeda) adlı kapsül şeklindeki ilaca, 15 Eylül 2021'de FDA (ABD Gıda ve İlaç İdaresi) hızlandırılmış onay verdi.
İlaç, platin bazlı kemoterapi sırasında veya sonrasında hastalığı ilerleyen ve FDA onaylı bir testte EGFR ekson 20 insersio mutasyonu tespit edilen hastaların kullanımı için, yani ikinci basamak tedavi olarak onaylanmıştır.
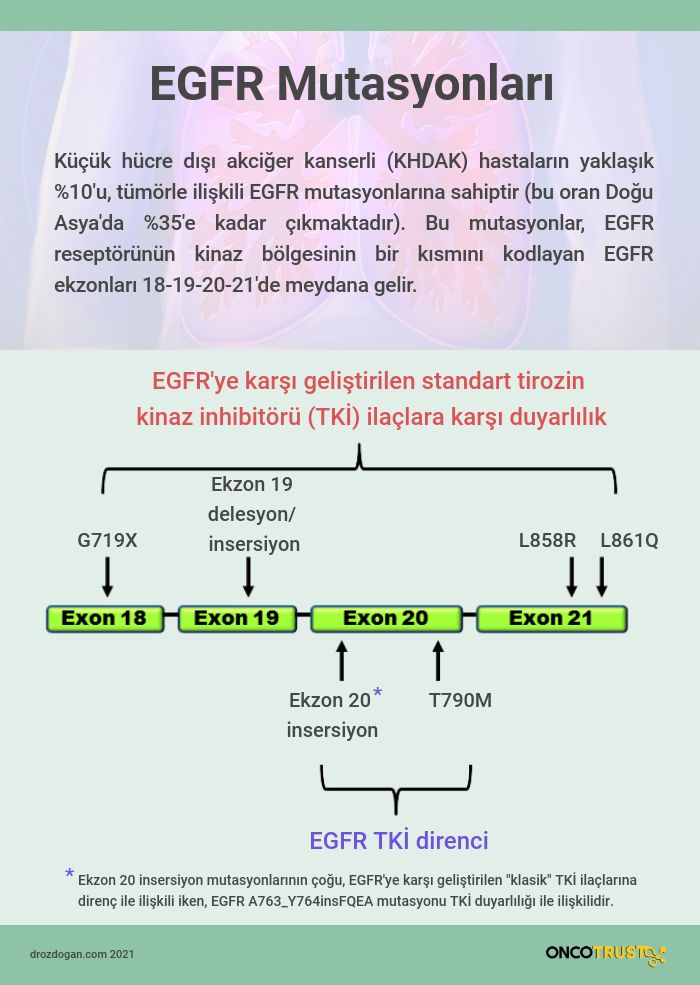
EGFR Exon 20 insersio mutasyonu
Mobocertinib, akciğer kanserinde daha baskın diğer EGFR mutasyonlarından daha az yaygın olan bu ekson 20 mutasyonları hedeflemek için özel olarak tasarlanmış ilk oral tirozin kinaz inhibitörüdür (TKI).
Mobocertinib, EGFR ekson 20 insersio mutasyonu için FDA onayı alan 2. ilaçtır. Daha önce 21 Mayıs 2021'de FDA, etken maddesi amivantamab-vmjw olan Rybrevant adlı ilacı, tümörleri EGFR ekson 20 insersio mutasyonu taşıyan hastalar için onaylamıştı.
EGFR Exon20 ekleme mutasyonları, KHDAK hastalarının yaklaşık %1-2'sini oluşturur ve Batılı toplumlara kıyasla Asya toplumlarında daha sık görülür.
Mobocertinibe FDA onayı getiren çalışma
Yeni onay 114 hastadan oluşan tek kollu bir faz 1/2 klinik çalışmadan gelmektedir. Çalışmanın ölçmek istediği ana sonlanım noktaları, objektif yanıt oranı ve yanıt üresidir. Hastaların hepsi daha önce platin bazlı kemoterapi almışlardı ve mobocertinib dozu günlük 160 mg idi.
- Bağımsız bir inceleme komitesine göre, mobocertinib %28'lik bir onaylanmış objektif yanıt oranı ve ortanca 17.5 aylık yanıt süresi gösterdi.
- Ortanca genel sağkalım süresi 24 ay ve progresyonsuz (ilerlemesiz) sağkalım süresi 7.3 aydı.
Mobocertinib uygunluğu için FDA, yeni nesil dizileme (NGS) testi olarak Thermo Fisher Scientific'in EGFR Exon20 eklemeleri olan KHDAK hastalarını tanımlayan Oncomine Dx Hedef Testini onayladı.
NGS testi, EGFR Exon20 eklemelerinin %50'sinden daha azını tespit eden polimeraz zincir reaksiyonu (PCR) testine kıyasla daha doğru teşhisler sağlayabildiğinden, bu hastalar için kritik öneme sahiptir.
Mobocertinib ile görülen en yaygın (> %20) yan etkiler ishal, döküntü, mide bulantısı, stomatit, kusma, iştah azalması, paronişi (tırnak dolama), yorgunluk, kuru cilt ve kas-iskelet ağrısı idi.
FDA grants accelerated approval to mobocertinib for metastatic non-small cell lung cancer with EGFR exon 20 insertion mutations. fda.gov 16 Sep 2021.






