
Ercüment Ovalı ve ekibinin koronavirüs aşısının bilimsel makalesi üzerine
Yeni tip koronavirüs olan şiddetli akut solunum sendromu koronavirüs 2 (SARS-CoV-2), ilk olarak Aralık 2019’da Çin’in Wuhan kentinde tespit edildi ve Covid-19 hastalığına sebep olarak tüm dünyayı etkisi altına aldı. Virüsün yeni olması ve aşısının olmamasından dolayı ciddi ölçüde bir sağlık krizi yarattı. Covid-19 vakalarının sayısı dünya çapında şok edici bir hızla artarak “ikinci dalganın” sınırlarını zorladı. 13 Aralık’tan beri teyit edilen toplam vaka sayısı 120 milyonu, ölü sayısı ise 2.6 milyonu aştı. Bu nedenle SARS-CoV-2 aşıları, hastalık ve ölüm oranını azaltmak için çok önemli bir hal aldı.
Maalesef ki Covid-19 hastalığı için halen net ve spesifik bir tedavi bulunmamaktadır. Çeşitli ilaçlar ve hücresel tedaviler gibi çeşitli tedavilerin araştırmaları devam etmektedir. Fakat bu tedavilerin etkinliği henüz yükseltilememiştir. Tedavinin eksikliğinden dolayı da SARS-CoV-2 aşısına acil bir şekilde ihtiyaç duyulmaktadır. Bu acil ihtiyaca karşı, Covid-19 hastalığı için geliştirilmekte olan 160 aşı adayının bazılarının umut vadedici sonuçlarının olduğu bildirildi (bakınız Koronavirüse karşı AŞI YARIŞI – resimli bir rehber).
Ülkemizde geliştirilen koronavirüs aşı adaylarının etkinlik ve güvenlik analizi
Prof. Dr. Ercüment Ovalı ve ekip arkadaşları, geliştirdikleri aday aşıların gama ışını ile inaktive edilmesi sonucu in vitro ve in vivo çalışmalarda etkinlik ve güvenlik analizlerini yaptı. Çalışma 11 Mart'ta Nature'a bağlı Scientific Reports adlı dergide yayımlandı. Çalışmada aday aşılar olarak, etkisiz hale getirilmiş SARS-CoV-2 virüs aşısı olan OZG-38.61 versiyon 1 ve GM-CSF adjuvan eklenmiş bir aşı olan SK-01 versiyon 1'e yer verildi. Ekip, bu aday aşıları toksisite ve immünojenisite açısından değerlendirmek için BALB /c farelerine intradermal olarak uyguladı.
Özellikle GM-CSF içeren aşı modelleri, T ve B hücre yanıtları açısından bakıldığında, nötralizasyon kapasitesine sahip önemli antikor üretimine neden olduğu gözlemlendi.
Aşılanmış farelerin, tamamen etkisiz hale getirilmiş SARS-CoV-2 veya peptit havuzu ile yeniden uyarılmalarının akabinde T hücresi yanıtı gösterdiği görüldü.
Bu çalışma, aşıların etkili olduğunu ve insan özellikleri tanımlanmış ACE2+ farelerinde enfektif (hastalık bulaştırıcı) SARS-CoV-2 virüsü için gama ışını ile inaktif hale getirilen aşı adaylarını araştırmak adına ekibin zorlu teste başlanmasına yol açtığını göstermektedir.
Gama ışını ile inaktive edilmiş SARS‑CoV‑2 aşı adayı üretimi
RT-PCR ile Covid-19 tanısı alan 4 hastadan nazofarengeal ve orotafingeal sürütün örnekleri alındı. Daha sonra gama ışını ile inaktive edilen SARS-CoV-2 için bir aday aşı üretildi.
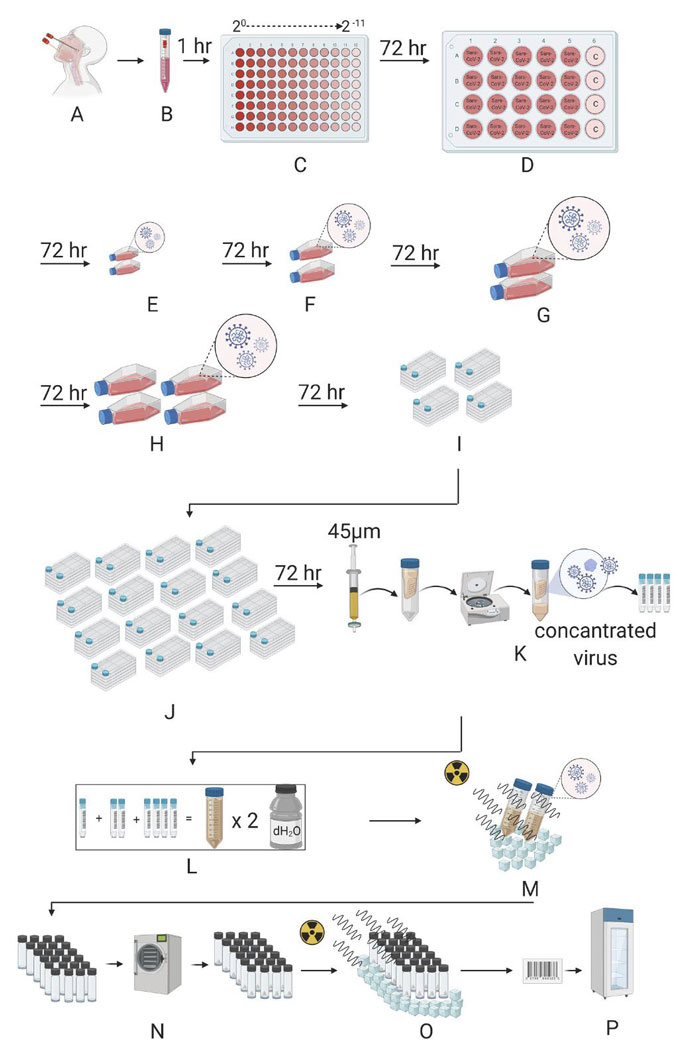
(A) Nazofarengeal ve orofaringeal örnekler alınır. (B) Örnekler, 2 – 8 °C 'lik transfer solüsyonunda laboratuvara getirilir. (C) Virüs, Vero hücrelerine seri seyreltme yapılarak dağıtılır. (D) Virüsler 24 oyuklu bir plakaya, (E ve F) T-75, (G) T-175 ve (H) T-300 Vero hücreli flasklara kültürleme yüzel alanı artırılarak aktarılır. Bir sonraki adımda, çoğaltılan virüs, (I) 4 ve (J) 16 çok katmanlı Vero hücreli flasklara aktarılır. (K) Daha sonra, toplam virüs çözeltisi 45 µm’lik bir filtreden geçirildi. Virüs 100 KDa filtreli özel bir tüpte santrüfüj edilerek konsantre edildi. Konsantre edilmiş virüs, ışınlanmadan önce –80 °C ’de saklanır. (L) Elde edilen tüm konsantre virüsler bir araya toplanır ve 100 KDa'lık bir yoğunlaştırıcıda diyafltrasyon için damıtılmış su ile iki kez yıkanır. (M) Konsantre edilmiş virüs karışımı, kuru buz içinde 25 kGy'de ışınlama ile inaktive edilir. (N) İnaktive edilmiş virüs, doz ayarlamasından sonra liyofilize edilir. (O) Liyofilize virüs karışımı, kuru buz içinde 25 kGy'de ışınlama ile sterilize edilir. (P) Liyofilize tüplere konmuş inaktif SARS-CoV-2 aşısı etiketlenir ve 4 ° C'de saklanır.
Toksisite ve güvenlik analizleri
Araştırmacılar, aşı adaylarının 7 günlük ve 21 günlük toksisite dahil güvenilirliğini test etmek için, fare gruplarına adjuvanlı ve adjuvansız tek doz intradermal olarak uyguladı.
Bir haftalık analiz
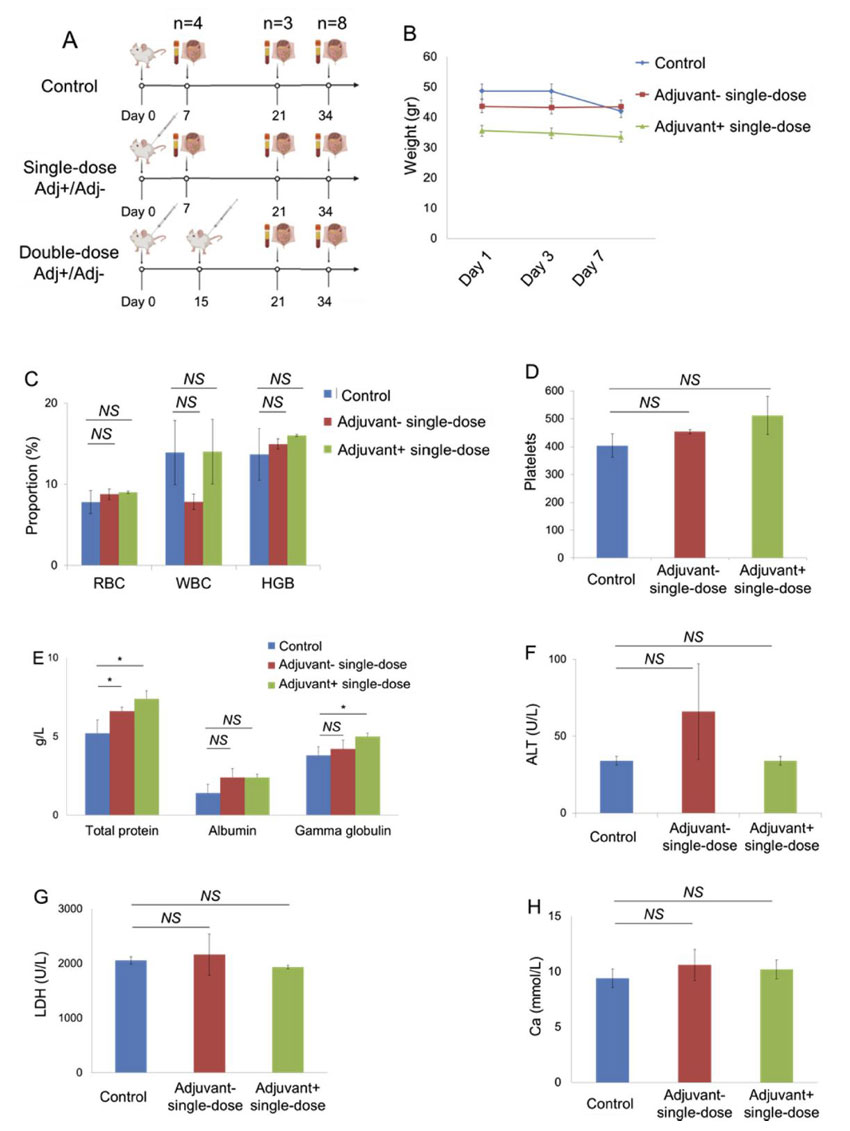
Bir haftalık takipte, kontrol fare grubuna kıyasla gruplarda önemli bir ağırlık değişikliği tespit edilmedi. Bununla birlikte, çalışma grupları kontrol ile karşılaştırıldığında, adjuvan içeren aşı grubunda gammaglobulinde önemli bir artış ve ilgili protein artışı olmuştur. Toksisite analizlerinde, Ca, ALT ve LDH değerleri gruplar arasında önemli ölçüde farklılık göstermedi. 7. günde yapılan histopatolojik analizde gruplar arasında dalak, karaciğer, akciğer, bağırsak, hipokampus, böbrek ve deri örneklerinde herhangi bir farklılık gözlenmedi. Serebellum dokularının incelenmesinde kontrol grubuna göre istatistiksel olarak anlamlı bir patoloji gözlenmedi. Adjuvan negatif tek doz grubunda yoğun Purkinje hücreleri gözlemlendi. Ancak bu yoğunluk, kontrol grubuna kıyasla önemli (p> 0.05) görünmüyordu.
Bu toksisite analizleri araştırmacıları, farelerde hem adjuvanlı hem de adjuvansız aşı adayları ile in vivo etkinlik ve doz çalışmasına yönlendirdi.
Uzun vadeli analiz
21 gün sonraki histopatoloji analizi, akciğer, karaciğer, bağırsak jejunumunda, dalakta, beyincikte, hipokampusta, böbrek ve deri dokularında önemli bir patolojik bulgu göstermedi. Tüm gruplarda dalağın histolojik bölümlerinde çok sayıda megakaryosit ve trabekül odağı belirlenmiştir.
Fare gruplarından elde edilen beyin dokularında beyincik kesitleri üzerine çalışmalar yapıldı. Özellikle tüm grupların serebellum korteksindeki Purkinje nöronlarının şekil ve boyama özelliklerinde istatistiksel olarak anlamlı bir farklılık yoktu. İlginç bir şekilde, adjuvan-negatif tek dozlu gruptaki hücreler, diğer gruplara kıyasla daha iyi şekillere sahipti. Tüm gruplarda dentat girusta ve hipokampusun piramidal tabakasında patolojik bulguya rastlanmadı.
Böbrekte distal ve proksimal tübüller tüm gruplarda benzer şekilde gözlemlendi. Diğer yandan, adjuvan pozitif çift doz aşı uygulama grubunda analiz edilen deri ve böbrek dokularında istatistiksel olarak anlamlı (p <0.05) bir inflamatuvar reaksiyon gözlemlendi.
Ayrıca aşılanan tüm gruplarda glomerulus yapıları normaldi. Deri dokusunun toksisite analizinde, çift doz gruplarında derinin aşılama noktalarının bazı dermis bölgelerinde enflamatuvar hücre infiltrasyonu ve eozinofiller tespit edildi. Aşı adaylarının dokular üzerinde önemli bir toksisitesi yoktu.
Analiz, 21. günde aşıyı alan fare gruplarından toplanan kan serumlarında T1, T2 ve T17'ye bağlı sitokin salımlarında bir artış olup olmadığını araştırmak için de yapıldı. Kontrol grupları ile karşılaştırıldığında, hiçbir uygulama grubunda istatistiksel olarak anlamlı sitokin artışı gözlemlenmedi. Bulgular, fare gruplarında SK-01 V1 ve OZG-3861 V1'in toksik yan etkisi olmadığını göstermektedir.
Klinik öncesi etkinlik ve doz çalışması
SARS-CoV-2 spesifik IgG antikor analizi, kandan izole edilen serumda üç farklı titrasyonda gerçekleştirildi. IgG ELISA sonucuna göre, kontrol grubu farelerine kıyasla tüm gruplarda önemli ölçüde artmış SARS-CoV-2 IgG antikoru saptandı (p <0.05).
Çift doz SK-01 V1'in, kontrol serum grubuna kıyasla, 1: 256 dilüsyonlarda bile önemli ölçüde enfektif virüsü nötralize edebildiğini gözlemlendi. Aynı çalışmanın tek doz SK-01 V1 ve tek ve çift doz OZG-3861 V1 için yapılması, 1: 256 dilüsyonda çift doz OZG-3861 V1'in de virüs nötralizasyon kapasitesine sahip olduğunu gösterdi. Tek doz SK-01 V1 veya OZG-3861 V1, 1: 256 dilüsyonda anlamlı bir nötralizasyon etkinliği göstermemekle birlikte (p> 0.05), 1: 128 dilüsyonda nötralizasyon kapasitesine sahip olduğu değerlendirildi.
Çift doz SK-01 V1'in, kontrol serum grubuna kıyasla, 1: 256 dilüsyonlarda bile önemli ölçüde enfektif virüsü nötralize edebildiğini gözlemlendi. Aynı çalışmanın tek doz SK-01 V1 ve tek ve çift doz OZG-3861 V1 için yapılması, 1: 256 dilüsyonda çift doz OZG-3861 V1'in de virüs nötralizasyon kapasitesine sahip olduğunu gösterdi. Tek doz SK-01 V1 veya OZG-3861 V1, 1: 256 dilüsyonda anlamlı bir nötralizasyon etkinliği göstermemekle birlikte (p> 0.05), 1: 128 dilüsyonda nötralizasyon kapasitesine sahip olduğu değerlendirildi.
Bu çalışmada kontrol farelerinde tespit edilen yüksek oranda nötralize edici antikorlar (3 fareden 2'sinde – %66), farelerin daha önce SARS-CoV-2 ile ilgili koronavirüs ailesinin bir üyesi olan fare hepatit virüsü (MHV) gibi viral bir enfeksiyon geçirmiş olabileceğini düşündürmektedir. Bu nedenle, bu çalışmanın bulguları, spontan nötralize edici antikorlar için negatif olduğu düşünülen farelerde testi tekrarlama ihtiyacını göstermektedir. Ancak ADE (antikora bağlı güçlendirme) testi, neredeyse nötralize edici antikor testinin bir doğrulaması gibi çalıştı ve oluşan antikorların ADE 'ye neden olmadan virüsü nötralize ettiğini gösterdi.
Fare serumu ile yapılan bu in vitro analiz, SARS-CoV-2'ye özgü nötralize edici antikorun, ADE etkisi olmaksızın SK-01 ve OZG-3861 aşı adaylarının ilk versiyonları ile farelerin bağışıklık kazandırma yardımıyla üretildiğini gösterdi.
Bu çalışmada, B hücre aktivitesine bağlı antikorların varlığının tespitini takiben, T hücresi yanıtı, tamamen inaktive edilmiş SARS-CoV-2 virüsü veya SARS-CoV-2 spesifik S, N ve M protein peptit havuzu ile yeniden uyarılma üzerine test edilmiştir.
T hücreleri, 21. günde veya 34. günde fareler diseksiyon edildi ve dalak dokularından izole edildi. T hücreleri SARS-CoV-2 antijenleri ile inkübe edildiğinde, sitokin salgılama profili 72 saat boyunca değerlendirildi. Daha sonra, T1 ve T2 hücre yanıtlarının dengesi belirlendi ve IL-12'nin ve IFNy'nin IL-4'e oranında bir artış gösterdi.
Bu, aşı adaylarımızın, kontrol farelerinin dalaklarından izole edilen kontrol T hücrelerine ilişkin olarak ağırlıklı bir şekilde Th1 CD4 T hücresi tepkisine eğilimli olduğunu gösterdi. Ayrıca, peptit havuzu ile yeniden uyarılma üzerine bir adjuvan negatif tek doz (OZG-3861 V1) ve adjuvan pozitif çift doz (SK-01 V1) ile aşılanmış farelerden sitotoksik CD8 T hücrelerinin oranında önemli bir artış tespit edilmiştir. Bu, viral antijenlerin, aşılamadan 34 gün sonra CD8 T hücresi çoğalmasına neden olduğunu gösterir. Ancak, her iki T hücresi alt tipinde T hücresi aktivasyon belirteci olan CD25'te artış olmamıştır.
SARS-CoV-2'ye özgü T hücre yanıtını değerlendirmek için, IFNy ELISPOT plakasında noktalar olarak sayılan spesifik IFNg salgılaması sağlayan uyarılmış T hücreleri analiz edildi. Bulgular özellikle, 21. günde dalaklardan izole edilen T hücrelerindeki IFNg artışının, kontrol fare grubunun aksine, adjuvan içeren tek veya çift doz SK-01 V1 aşı adayında olduğunu gösterdi.
OZG-3861 V1 aşı adayının adjuvansız çift dozunda önemli bir farklılık olmamasına rağmen, tek doz uygulamada IFNg'de bir artış tespit edildi. Diğer yandan, tek veya çift doz OZ-3861 V1'in 34. günde diseksiyon sonrasında farelerin dalaklarından izole edilen T hücrelerinden önemli bir IFN salgısı ve tek bir doz SK-01 V1 saptandı.
Bu analiz, SK-01 V1 ve OZG-3861 V1 aşı adaylarının sadece B hücresi yanıtı değil, aynı zamanda T hücre yanıtı elde edebileceğini gösterdi.
Çalışmanın sonucu
Tüm viral aşılar, korumaya çalıştıkları virüs benzeri materyaller içerir. Bu, bağışıklık sistemini bir yanıt üretmeye ve gerçek bir viral enfeksiyonla karşılaştığında kullanıma hazır antikorlar üretmeye yönlendirir. Ancak virüsün mutasyona uğrayarak "kaçış mutantları" oluşturması endişe vericidir. Bunlar, aşıyla indüklenen antikorların tanımadığı virüsün mutasyona uğramış versiyonlarıdır. Önemli bir bağışıklama için, topluluk içindeki virüsün genetik varyasyonunu kapsayan bir aşı profili oluşturmak gerekir.
- İlgili konu: Koronavirüsün yeni varyantı-mutasyonu nedir? Nasıl keşfedildi? Aşılar etkili olacak mı?
Aşının temsil ettiği genetik varyasyon küçükse, toplumsal bağışıklığı tetiklemek istenen oranda olmayacaktır.
Bu nedenle, birden fazla inaktif viral suşun üretimi ve seçimi, başarılı viral aşıların üretilmesi için önemli bir mekanizma olmaya devam etmektedir.
Bu çalışmada ekip, insan ACE2 kodlayan transgenik fareleri aşıladı ve onları yükleme testi için enfektif SARS-CoV-2 virüsü ile enfekte etti. Aşılanmış farelerin toksisite analizinde, deri ve böbrekte enflamatuar reaksiyonun bitmesi nedeniyle yeni tasarlanan versiyon 2 aşı modelinde adjuvan pozitif çift doz uygulamasının kaldırılması gerektiğine karar verilmiştir. Ayrıca, GM-CSF adjuvanının varlığında veya yokluğunda genel resim immünizasyonu, antikor ve T hücre yanıtlarında önemli farklılıklar vermemiştir. Bu çalışma ile, GM-CSF bir adjuvan olarak kullanıldığında aşılamada önemli bir farklılık gözlenmemiştir.
Çalışmalar ayrıca intradermal GM-CSF ile enjeksiyonun intradermal olarak uygulanan alanlarda, uzak bölgelere kıyasla greftleme gücünde önemli artışlara yol açtığını göstermiştir. Bu da intradermal olarak uygulanan inaktif virüs aşılarında GM-CSF'nin yetersizliğini açıklayabilir. Bu nedenle, aşı adaylarının 2. versiyonunda SARS-CoV-2 etkin viral kopya dozunun artırılmasına karar verilmiştir. T ve B hücre yanıtları açısından, özellikle adjuvan olarak GM-CSF içeren aşı modellerinin, ADE özelliği olmadığında nötralizasyon kapasitesine sahip anlamlı antikor üretimine yol açtığı görülmüştür.
Diğer yandan ACE2, insanlarda çeşitli hücre türlerinde her yerde eksprese edilir. SARS-CoV-2 ve ACE2 arasındaki etkileşim, SARS-CoV2 enfeksiyonunun patogenezini belirlediği bilinen çeşitli yolları uyarmasıdır. SARS-CoV-220 ile etkileşimin ardından enzimin endositozunu takiben ACE2 aracılı kardiyovasküler korumanın kaybolduğu, multiorgan yetmezliği ve bağırsak disbiyozunun meydana geldiği bildirilmiştir. Ancak klasik inaktive aşı tedavilerinin çoğundan farklı olarak, uygun immünizasyon için daha yüksek konsantrasyonda inaktive virüs gereksinimini azaltan farelerde intradermal yolu kullanarak aşı adayını (OZG-38.61.1) uygulandı. Bu nedenle, derinin epidermal katmanını dolduran yalnızca Langerhans hücreleri (LH'ler) olarak adlandırılan özelleşmiş dendritik hücrelerin, uygun aşılama için enjeksiyon bölgesinde inaktive edilmiş SARS-CoV-2 partikülleri ile hazırlanmasını beklendi. Bu çalışmada gerçekleştirilen histopatolojik analizde ve yakın zamanda ekibin yayımladığı ön baskıda da aşılama prosedürlerinin güvenliğini destekleyen herhangi bir çoklu organ yetmezliği veya kardiyovasküler bozukluk belirtisi tespit edilmedi.
Başka bir bulgu da adjuvan varlığının, uzun vadeli bağışıklık kazandırmaya yol açabilen B hücresi tepkisine kıyasla T hücresi tepkisinde daha önemli olduğunu gösterildi. Ayrıca bu çalışma ile gama ışını uygulanmış inaktive aşı adaylarının uzun süreli T hücre yanıtı ile birlikte SARS-CoV-2'ye özgü antikorların üretimini etkin bir şekilde tetikleyebildiği görülmüştür.
Bu çalışmada, gama ışınlı inaktive SARS-CoV-2 virüsleri ile oluşturulan OZG - 38.61.3 aşı adaylarının, özellikle 10 üzeri 14 viral kopya formülasyonunda etkili olmak üzere nötralize edici antikorlar ürettiği gösterilmiştir. Bu da farelerde transgenik insan ACE2 ifade etmede etkili oldu. Enfeksiyona karşı koruyabileceği gösterildi.
Prof. Dr. Ercüment Ovalı yaptığı açıklamada, GM-CSF'yi yeni yaptıkları çalışmada çıkarttıklarını açıkladı. Böylelikle nörotoksisiteden kaçınılmış. Yeni aşıda adjuvandan vazgeçip virus dozunu artırdıklarını ve yakında çıkacak makalelerinde daha etkili sonuçlar vereceklerini duyurdu. Hatta viral challange sonrası sadece virus yükünü azaltmayıp dünyada ilk kez bobrekleri de koruduğunu gösterdiklerini ifade etti.
İLGİLİ KONULAR
Ovali E. ve ark. (2021). Preclinical efcacy and safety analysis of gamma irradiated inactivated SARS CoV 2 vaccine candidates. Nature: www.nature.com/scientificreports adresinden alındı






