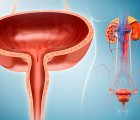
4. Evre Ürotelyal (Mesane ve İdrar Yolları) Kanserler İçin Enfortumab Vedotin-Ejfv FDA Onayı Aldı
18 Aralık 2019'da, ABD Gıda ve İlaç İdaresi (FDA), lokal / bölgesel olarak ilerlemiş veya metastatik ürotelyal (mesane ve idrar yolları) kanserler için enfortumab vedotin-ejfv (Padcev) adlı ilaca hızlandırılmış onay verdi. Ürotelyal kanserli hastalarda bu ilacın kullanılması için, daha önce anti-PD-1 veya anti-PD-L1 sınıfı immünoterapi ve neoadjuvan / adjuvan veya metastatik ortamda platin içeren bir kemoterapi almış olması gerekmektedir.
9 Temmuz 2021'de Astellas, Padcev'in (enfortumab vedotin-ejfv) FDA tarafından düzenli onaylandığını ve endikasyonunun şu şekilde genişletildiğini duyurdu: "Sisplatin içeren kemoterapi için uygun olmayan ve daha önce bir veya daha fazla tedavi almış olan bölgesel olarak ileri veya metastatik ürotelyal kanserli yetişkin hastaların tedavisinde tekli ajan olarak". FDA'nın hızlandırılmış onaydan düzenli onay ve etiket genişletmesine geçmesinde faz-3 EV-301 çalışma sonuçlarının etkisi oldu.
Enfortumab Vedotin-Ejfv Etki Mekanizması Nasıldır?
Enfortumab vedotin-ejfv, FDA onayı alan ilk Nectin-4-hedefli antikor-ilaç konjugatıdır.

Enfortumab vedotin, hücrelerin yüzeyinde bulunan ve mesane kanseri hücrelerinde yüksek oranda eksprese (ifade) edilen bir protein olan Nectin-4'e yönelik birinci sınıf bir antikor-ilaç konjugatıdır. Klinik öncesi veriler, enfortumab vedotinin antikanser aktivitesinin, Nectin-4 eksprese eden hücrelere bağlanmasından, ardından mikrotübül (hücre iskeleti) bozucu bir anti-tümör ajanın hücreye girmesi ve serbest bırakılmasından kaynaklandığını ve bunun sonucunda hücrenin çoğalmasının durması ve apoptozun (programlanmış hücre ölümü) tetiklenmesinden kaynaklandığını düşündürmektedir (bakınız yukarıdaki şekil). Enfortumab vedotin, Seattle Genetics ve Astellas işbirliği kapsamında 2007'de beri geliştirilen bir ilaçtır.
EV-201 Çalışması
PD-1 veya PD-L1 inhibitörü ve platin bazlı kemoterapi ile önceden tedavi alan, lokal olarak ileri veya metastatik ürotelyal kanserli 125 hastayı kapsayan tek kollu, çok merkezli bir klinik çalışma olan EV-201'de bu ilacın etkinliği araştırıldı.
Hastalar, hastalığın ilerleyişine veya kabul edilemez toksisiteye kadar 28 günlük bir dönemin 1., 8. ve 15. günlerinde 1.25 mg / kg enfortumab vedotin-ejfv aldı. Ana etkinlik sonuç ölçümleri, objektif cevap oranı ve yanıt süresi olarak teyit edildi.
- Objektif cevap oranı, sırasıyla % 12 ve % 32'lik tam ve kısmi yanıtlama oranları ile % 44'dür.
- Tahmini medyan (ortanca) cevap süresi 7.6 aydı.
- Daha önce en az 2 basamak tedavi almış böyle bir hasta grubunun % 12'sinin tedaviye tam yanıt vermesi oldukça dikkat çekici bir sonuçtur.
En sık görülen (≥% 20) yan etkiler, yorgunluk, periferik nöropati, iştah azalması, döküntü, alopesi (saç dökülmesi), bulantı, disgezi (tat duyusunun bozulması), ishal, kuru göz, kaşıntı ve kuru cildi içerir. Enfortumab vedotin-ejfv ile tedavi edilen hastalarda nadir olarak, önceden var olan diabete (şeker hastalığına) bakılmaksızın diyabetik ketoasidoz ve ölüm meydana gelmiştir. Kan şekeri düzeyleri, diabetes mellitus veya hiperglisemisi olan veya risk altındaki hastalarda yakından izlenmelidir.
Önerilen enfortumab vedotin-ejfv dozu, hastalığın ilerlemesi veya kabul edilemez toksisitesine kadar 28 günlük bir döngünün 1., 8. ve 15. günlerinde 30 dakika boyunca intravenöz infüzyon şeklinde uygulanan 1.25 mg / kg'dır (en fazla 125 mg doz).
İlgili konu: Mesane Kanseri Tedavisinde Dikkat Çekici Sonuç – Enfortumab Vedotin Artı Pembrolizumab