İleri Evre HDR Pozitif Over Kanseri İçin Niraparib, FDA Onayı Aldı
23 Ekim 2019'da, ABD Gıda ve İlaç İdaresi (FDA), üç ya da daha fazla kemoterapi rejimi ile tedavi edilen ve kanseri homolog rekombinasyon eksikliği (homologous recombination deficiency, HRD) yönünden pozitif olan ileri evre over, fallop tüpü veya primer periton kanseri olan hastalar için niraparib (Zejula) adlı ilacı onayladı.
Homolog rekombinasyon eksikliği (HRD) durumu şu şekilde tanımlanmıştır: zararlı veya şüpheli zararlı bir BRCA mutasyonu veya son platin bazlı kemoterapiye yanıt verdikten altı aydan daha sonra hastalık ilerlemesi olan hastalarda genomik instabilite.
Niraparib'e 2. FDA Onayını Getiren Çalışma
Tek kollu QUADRA adlı klinik araştırmada, HRD-pozitif tümörleri olan ileri evre over kanserli 98 hastada etkinlik araştırıldı. Hastalar daha önce üç basamak ya da daha fazla kemoterapi ile tedavi edildi. Daha önce PARP inhibitörleri alan hastalar çalışma dışı bırakıldı. BRCA mutasyonu olmayan hastalar için, son platin bazlı tedavinin dozundan en az altı ay sonra kanserinde ilerleme olma şartı arandı. HRD pozitif durum Myriad myChoice CDx testi kullanılarak ölçüldü ve 63 hastanın tümöründe BRCA mutasyonu vardı (t BRCA m) ve 35 hastada genomik instabilite skoru (GIS) ≥ 42 idi. Tüm hastalara, hastalığın ilerleyişine veya kabul edilemez yan etkiler görülene kadar günde bir kez 300 mg niraparib verildi.
NOT: Niraparib, daha önce 2017'de, platin bazlı kemoterapiyle tamamen veya kısmen tümörleri küçülmüş, fakat sonrasında hastalığı tekrar etmiş over, fallop tüpü veya primer peritoneal kanserli yetişkin hastaların idame tedavisinde - BRCA mutasyon durumundan bağımsız - onay almıştı (bakınız). QUADRA çalışmasının birincil etkinlik ölçütleri, objektif cevap oranı ve cevap süresi olarak belirlendi.
Sonuçlar
• HRD pozitif 98 hastada, objektif yanıt oranı % 24 idi. Hepsi parsiyel / kısmi yanıt idi.
• Tahmini ortanca yanıt süresi 8.3 aydı.
• BRCA mutasyonu pozitif hastalarda objektif yanıt oranları;
- platine duyarlı grupta % 39,
- platine dirençli grupta % 29,
- platine refrakter grupta % 19 bulundu.
Yan Etkiler
QUADRA'da niraparib alan hastaların % 73'ünde doz azalması veya kesinti görüldü. Doz azalması veya kesilmesi ile sonuçlanan en yaygın ( > % 5) yan etkiler, trombositopeni (% 40), anemi (% 21), nötropeni (% 11), bulantı (% 13), kusma (% 11), yorgunluk (% 9) ve karın ağrısı (% 5) idi.
Önerilen niraparib dozu, günde bir kez yemekli veya yiyeceksiz olarak alınan 300 mg'dır.
Niraparib Etki Mekanizması Nasıldır?
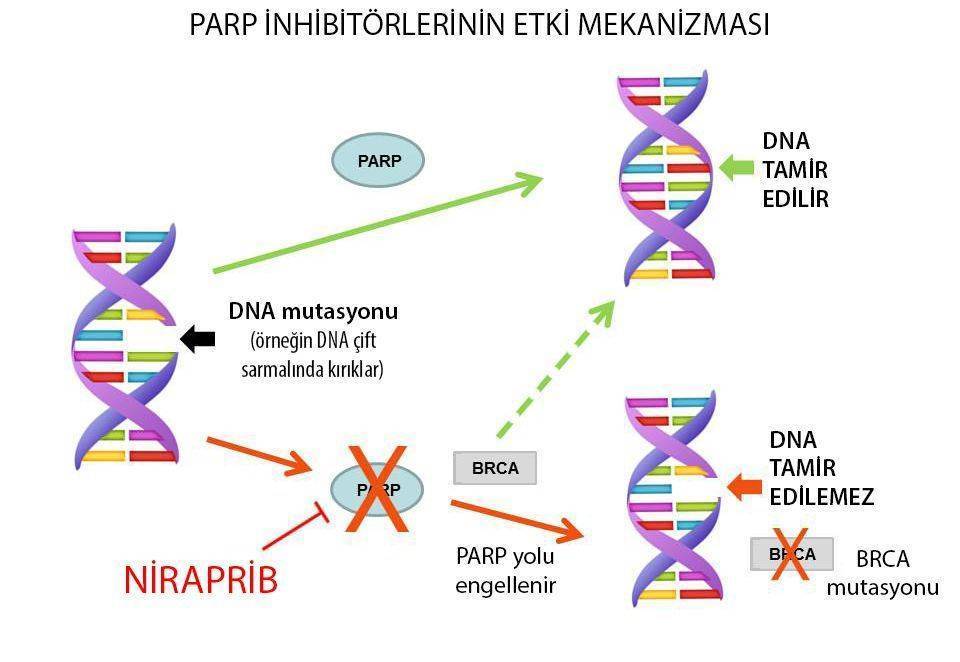
Kanserli hücreler, normal hücrelere göre çok daha fazla ve hızlı bölündükleri için, daha fazla DNA hasarı yani mutasyon meydana gelir. DNA’da hasar meydana geldiği zaman, çeşitli hücre içi mekanizmalar devreye girerek ya hasarı onarılır ya da hasar onarılamayacak düzeyde ise hücre apoptoza gider. Hem PARP hem BRCA, DNA onarımında rol alır. Over kanserinde bir PARP inhibitörü olan niraparib kullanıldığında, kanserli hücre DNA’sını tamir etme yeteneğini kısmen kaybeder. Bu hücrelerde aynı zamanda BRCA mutasyonu da varsa, kanserli hücrelerin DNA’larını tamir etme ve ölümsüz olarak kalma yetenekleri çok daha azalır.
FDA approves niraparib for HRD-positive advanced ovarian cancer.
fda.gov - 23 October 2019.