İleri evre endometriyal karsinom (rahim kanseri) için immünoterapi pembrolizumab (Keytruda) ve hedefe yönelik kanser ilacı lenvatinib (Lenvima) kombinasyon tedavisine ABD Gıda ve İlaç İdaresi (FDA) 17 Eylül 2019'da hızlandırılmış onay verdi. Bu yeni ikili tedavinin rahim kanserinde kullanılması için hastalar;
- Mikrosatellit instabilitesi yüksek (MSI-H) olmamalı,
- Yanlış eşleşme onarımı eksiliğine (dMMR) sahip olmamalı
- Ayrıca daha önce uygulanan sistemik kemoterapi tedavi sonrası hastalığında ilerleme gözlenmeli,
- Bununla birlikte küratif (tam şifa amaçlı) cerrahiye veya radyoterapiye uygun olmamalı.
Bu inceleme, FDA Onkoloji Mükemmeliyet Merkezi'nin bir girişimi olan Orbis Projesi kapsamında yapılmıştır. Proje Orbis, uluslararası ortaklar arasında onkoloji ilaçlarının aynı anda sunulması ve gözden geçirilmesi için bir çerçeve sunmaktadır. FDA, Avustralya Terapötik Mallar İdaresi ve Kanada Sağlık bu incelemede iş birliği yaparak üç ülkenin hepsinde eş zamanlı kararların alınmasını sağladı.
Pembrolizumab ve lenvatinib kombinasyonunun rahim kanserinde etkinliği, en az bir basamak sistemik kemoterapiden sonra ilerlemiş olan metastatik endometriyal karsinomlu 108 hastayı kapsayan tek kollu, çok merkezli, açık etiketli, çok kohortlu bir klinik araştırma olan Çalışma 111 / KEYNOTE-146'da araştırıldı.
Hastalar kabul edilebilir yan etki veya hastalığın ilerleyişine kadar her 3 haftada bir intravenöz olarak (damardan) verilen pembrolizumab 200 mg ile kombinasyon halinde günde bir kez oral olarak (ağızdan) 20 mg lenvatinib ile tedavi edildi.
108 hastanın 94'ünde MSI-H veya dMMR olmayan, 11'inde MSI-H veya dMMR olan tümörler vardı ve 3 hastada tümör MSI-H veya dMMR durumu bilinmiyordu. Tümör MSI durumu, bir polimeraz zincir reaksiyonu testi kullanılarak belirlendi. Tümör dMMR durumu, bir immünohistokimya testi kullanılarak belirlendi.
Ana etkinlik sonuç ölçümleri, bağımsız radyolojik inceleme komitesi tarafından belirlenen objektif yanıt oranı ve yanıt süresi idi.
Çalışmanın sonuçları
- Tümörleri MSI-H veya dMMR olmayan 94 hastada objektif yanıt oranı: 10 tam cevap (% 10.6) ve 26 kısmi cevap (% 27.7) ile toplam % 38.3 idi.
- Analiz sırasında ortanca yanıt süresine ulaşılmadı ve 25 hasta (yanıt verenlerin % 69'u) en az 6 ay boyunca bu kombinasyon tedavisine yanıt vermeye devam etti.
Bu onaydan önce, ileri evre rahim kanseri 2. basamakta standart tedavi, çeşitli kemoterapi uygulamaları idi ve bu tedaviler ile objektif yanıt oranları %7-15 aralığında bildirilmiştir. Pembrolizumab artı lenvatinib ile %40 varan bir yanıt görülmesi, onkoloji çevrelerinde oldukça dikkat çekici bir başarı olarak değerlendirilmiştir.
Endometrial karsinomda, lenvatinib ve pembrolizumab için en sık görülen yan etkiler (≥% 20), yorgunluk, hipertansiyon, kas-iskelet sistemi ağrısı, ishal, iştah azalması, hipotiroidi, mide bulantısı, stomatit, kusma, azalmış kilo, karın ağrısı, baş ağrısı, idrar yolu enfeksiyonu, disfoni (ses kısıklığı), hemorajik olaylar (kanama), hipomagnezemi (kanda magnezyum düşüklüğü), palmar-plantar eritrodisestezi (el-ayak ayalşarında döküntü), dispne, öksürük ve vücut döküntüsü idi.
Endometrial karsinom için, önerilen doz, her 3 haftada bir 30 dakikada bir intravenöz infüzyon halinde tatbik edilen 200 mg pembrolizumab ile günde bir kez oral olarak 20 mg lenvatinib şeklindedir.
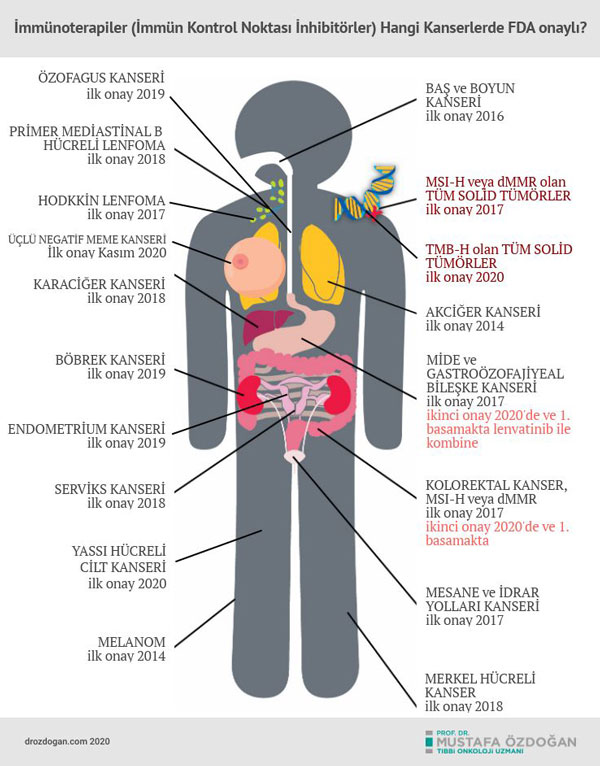
Aşağıda, bağışıklık sistemi kontrol noktası türü immünoterapilerin, şimdiye kadar FDA onayı aldıkları kanser türleri görülebilir: