Atezolizumab immünoterapisi, yüksek PD-L1 düzeyi olan akciğer kanserinin birinci basamak tedavisinde FDA onayı aldı
18 Mayıs 2020'de ABD Gıda ve İlaç İdaresi (FDA), tümörleri yüksek PD-L1 düzeyine sahip metastatik (4. evre) küçük hücreli dışı akciğer kanseri (KHDAK) olan yetişkin hastaların ilk basamak tedavisi için atezolizumabı (Tecentriq) onayladı. Kullanım şartı olarak PD-L1, tümör hücrelerinin ≥ % 50'sinde boyanmalı [TC ≥ 50%] veya tümör içine sızan bağışıklık sistemi hücreleri tümör bölgesinin ≥ % 10'unda PD-L1 boyanmalı [IC ≥ 10%] ve EGFR ve ALK genetik değişimleri olmamalı.
Eş zamanlı olarak FDA, atezolizumab tedavisi için KHDAK hastalarını seçmek için eşlik eden bir teşhis cihazı olarak VENTANA PD-L1 (SP142) Testini de onayladı.
IMpower110 çalışması
Atezolizumabın etkililiği, tümörleri PD-L1 (TC ≥ % 1 veya IC ≥ % 1) pozitif olan, 4. evre KHDAK'li hastalarda çok merkezli, uluslararası, randomize, açık etiketli bir çalışma olan IMpower110'da değerlendirildi. Hastalar, hastalık ilerlemesi veya kabul edilemez yan etki gelişene kadar her 3 haftada bir 1200 mg atezolizumab ya da platin-bazlı kemoterapi almak üzere rastgele 1:1 oranında iki kola ayrıldı. Temel etkinlik sonuç ölçütü genel sağkalım idi.
Sonuçlar
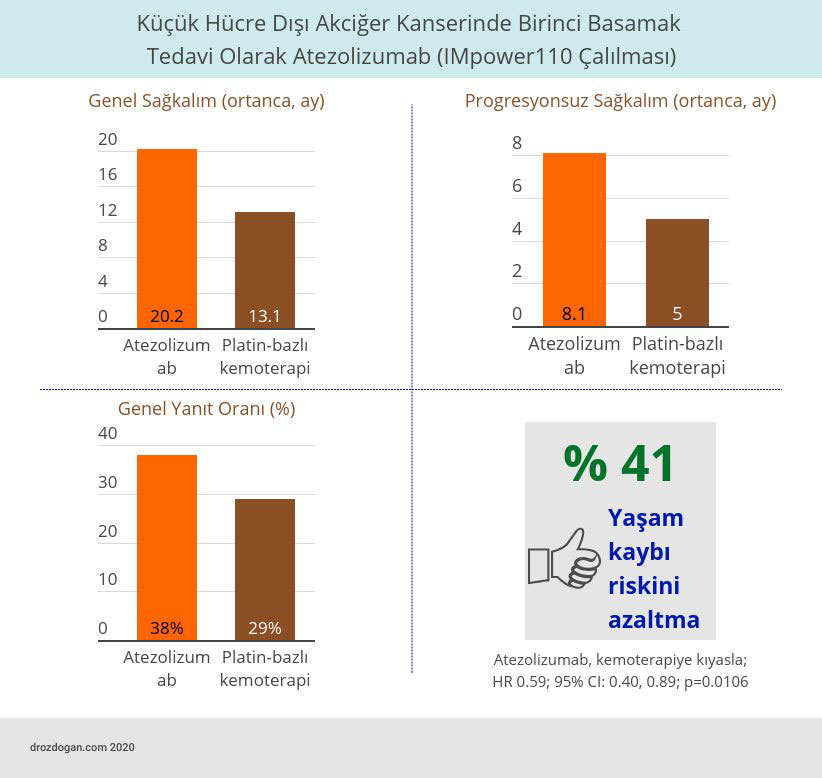
- Platin-bazlı kemoterapi ile tedavi edilenlere kıyasla, atezolizumab alan yüksek tümör PD-L1 düzeyi olan hastalar için genel sağkalımda istatistiksel olarak anlamlı bir iyileşme saptandı.
- Atezolizumab kolundaki hastalar için ortanca genel sağkalım 20.2 ay iken kemoterapi kolunda 13.1 ay idi.
- Bu grup hasta için başlangıç tedavisi olarak atezolizumab ile başlamanın, kemoterapiye kıyasla yaşam kaybı riskini % 41 azalttığı görüldü.
- Ara veya son analizlerde diğer iki PD-L1 alt grubu (TC ≥ % 5 veya IC ≥ % 5; ve TC ≥ % 1 veya IC ≥ % 1) için genel sağkalımda anlamlı bir fark yoktu.
- Ortanca progresyonsuz (ilerlemesiz) sağkalım (PFS), atezolizumab kolunda 8.1 ay ve platin bazlı kemoterapi kolunda 5 aydı.
- Genel yanıt oranı immünoterapi ile % 38 ve kemoterapi ile % 29 idi.
IMpower110'da tek ajan olarak atezolizumab ile en yaygın (> % 20) yan etki yorgunluk/asteni idi.
KHDAK tedavisi için önerilen atezolizumab dozu, 2 haftada bir 840 mg veya 3 haftada bir 1200 mg veya 4 haftada bir 1680 mg 60 dakikada intravenöz infüzyondur.
*
FDA approves atezolizumab for first-line treatment of metastatic NSCLC with high PD-L1 expression.
fda.gov - 18 May 2020