İmmünoterapi, mide kanseri birinci basamak tedavisine adını yazıyor
İleri evre mide ve mide-yemek borusu bileşke kanserlerinin birinci basamak tedavisinde pembrolizumab (Keytruda) adlı immünoterapinin etkinliğini gösteren KEYNOTE-062 çalışması, 3 Eylül 2020'de JAMA Oncology'de yayımlandı.
Mide ve mide-yemek borusu bileşkesinin adenokanseri, 2018'de dünya genelinde yaklaşık 1 milyon yeni vaka ve 783.000 ölümle dünya çapında kanser ölümlerinin üçüncü önde gelen nedenidir. Mide kanserlerinin %50 kadarı tanı anında ileri evredir. Tanı anında ameliyat edilemez veya metastaz yapmış ve HER2 negatif mide kanserlerinin tedavisine standart olarak sistemik kemoterapi ile başlanır. Bu birinci basamak kemoterapi ikili veya üçlü floropirimidin ve platin bazlı kemoterapi kombinasyon rejimleridir (örneğin FLOT). Bu rejimler ile medyan (ortanca) genel sağkalım 1 yıl veya daha kısa olmakla beraber yan etkileri de dikkat çekicidir.
Pembrolizumab (Keytruda), bağışıklık sisteminin kansere karşı pasifleştiren immün kontrol noktalardan biri olan PD-1 ve PD-L1 etkileşiminde, PD-1'e bağlanarak T-hücreleri aktive eden monoklonal antikor yapısında bir immünoterapi ilacıdır. Pembrolizumab, şimdiye kadar 16 farklı kanser türünde FDA onayı almıştır.
Mide kanseri için daha önce immünoterapi FDA onayı almıştı, fakat bu onay birinci basamakta değil, 3. basamak tedavi olarak ve PD-L1 pozitif hastalar içindi (bakınız 2017'de mide kanserinde pembrolizumab onayı).
KEYNOTE-O62 Çalışması
- Bu çalışmaya HER2 negatif, PD-L1 ≥1 olan, daha önce tedavi almamış, ameliyat edilemeyen bölgesel olarak ilerlemiş veya metastatik mide ve mide-yemek borusu bileşke adenokaserli hastalar alındı.
- Çalışma randomize, kontrollü, kısmi kör bir faz III klinik araştırma olarak tasarlandı.
- 29 ülke ve 200 merkez çalışmaya dahil edildi.
- Hasta alımı 18 Eylül 2015 ve 26 Mayıs 2017 tarihleri arasında yapıldı.
- Hastalar 3 kola ayrıldı:
- Pembrolizumab (tekli immünoterapi) koluna 256 hasta
- Pembrolizumab artı standart kemoterapi (sisplatin + 5FU ya da kapesitabin) koluna 257 hasta
- Sadece kemoterapi koluna 250 hasta olmak üzere toplam 763 hasta alındı.
- PDL-1 ≥10 hasta oranı tüm kollarda %36 düzeyinde idi.
- MSI-H hasta oranı tüm kollarda %6 düzeyinde idi.
- Hastalar ortanca 29.4 ay izlendi.
Sonuçlar
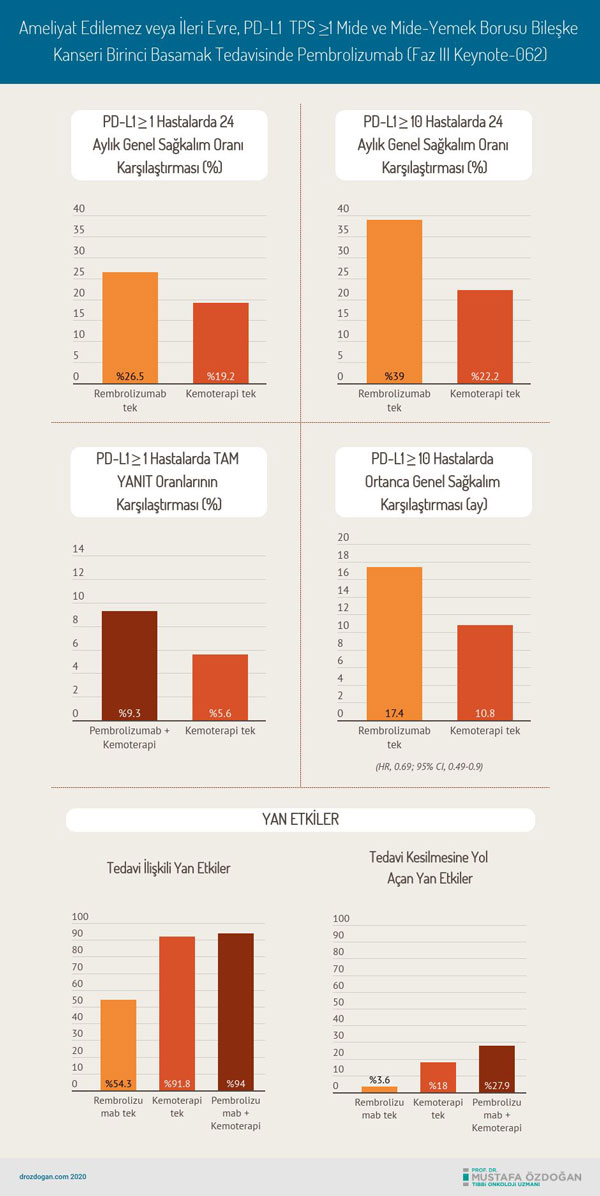
- Tedavi ile ilişkili yan etkiler;
- Pembrolizumab kolunda % 54,3
- Pembrolizumab + kemoterapi kolunda % 94
- Kemoterapi kolunda % 91,8
- Tedavinin kesilmesine yol açan yan etkiler;
- Pembrolizumab kolunda % 3,6
- Pembrolizumab + kemoterapi kolunda % 27,9
- Kemoterapi kolunda % 18,0
Tedavi etkinliği karşılaştırmaları ise şu şekilde:
- Pembrolizumab ve sadece kemoterapi uygulaması arasında genel sağkalım değerlendirmesinde PD-L1 ≥ 1 hastalarda fark yoktu:
- Pembrolizumab ile genel sağkalım 10.6 ay
- Sadece kemoterapi 11.1 ay
- Pembrolizumab ve standart kemoterapi arasında PD-L1 ≥ 1 hastalarda 24 aylık genel sağkalım oranı açısından fark vardı:
- Pembrolizumab ile %26.5
- Sadece kemoterapi %19.2
- Pembrolizumab ve kemoterapi arasında genel sağkalım değerlendirmesinde PD-L1 ≥ 10 hastalarda fark vardı (HR, 0.69; 95% CI, 0.49-0.9):
- Pembrolizumab ile 17.4 ay
- Standart kemoterapi ile 10.8 ay
- Pembrolizumab ve kemoterapi arasında 24 aylık genel sağkalım PD-L1 ≥ 10 hastalarda:
- Pembrolizumab ile %39
- Standart Kemoterapi ile %22.2
- Pembrolizumab + kemoterapi, sadece kemoterapiye karşı genel sağkalım değerlendirmesinde PD-L1 ≥ 1 veya PD-L1 ≥ 10 hastalarda anlamlı ek üstünlük yaratmadı:
- PD-L1 ≥ 1 olanlarda
- Pembrolizumab + kemoterapi ile 12.5 ay
- Sadece kemoterapi ile 11.1 ay
- PD-L1 ≥ 10 olanlarda
- Pembrolizumab + kemoterapi ile 12.3 ay
- Sadece kemoterapi ile 10.8 ay
- PD-L1 ≥ 1 olanlarda
- Pembrolizumab + kemoterapi, sadece kemoterapiye karşı yanıt oranları değerlendirmesinde PD-L1 ≥ 1 hastalarda:
- Tam yanıt:
- Pembrolizumab + kemoterapi ile %9.3
- Sadece kemoterapi ile %5.6
- Objektif yanıt:
- Pembrolizumab + kemoterapi ile %48.6
- Sadece kemoterapi ile %37.2
- Tam yanıt:
- PD-L1 ≥ 1 veya PD-L1 ≥ 10 olmasından bağımsız olarak pembrolizumab tekli veya pembrolizumab + kemoterapi alan MSI-H olan tüm hastalar, sadece kemoterapiye kıyasla genel ve progresyonsuz sağkalım verileri açısından anlamlı derecede üstündü.
Çalışmanın önemi ve yansımaları
- KEYNOTE-062, HER2 negatif ileri evre mide ve mide-yemek borusu bileşke adenokanseri tedavisinde PDL-1 CPS düzeyi ≥1 olan hastalarda 1. basamak pembrolizumab tedavisinin, standart kemoterapiden daha az yan etki ve benzer genel sağkalım oranına sahip olduğunu gösteren ilk faz III çalışmadır.
- İmmunoterapi etkinliği açısından öngörücü olan PD-L1 CPS ≥10 olmasından bağımsız olarak; MSI-H (mikrosatellit yüksek) tümörlerde 1. basamak immünoterapinin kemoterapiye üstünlüğünün ve genel sağkalım katıkısının gösterildiği ilk çalışmadır.
- Daha az yan etki sebebi ile genel durumu iyi olmayan ileri evre PD-L1 pozitif mide adenokanseri birinci basamak tedavisinde immünoterapi dikkate alınmalıdır.
- Standart kemoterapiye pembrolizumab eklenmesinin klinik olarak anlamlı katkısı bu çalışmada gözülmedi.
- Çalışma sonuçlarına dayanarak uluslararası klavuzlarda 1. basamak HER2 nehatif PD-L1 pozitif mide ve mide-yemek borusu adenokanseri önerileri ve klinik pratiğimiz değişecekdir.
Kohei Shitara et al. Efficacy and Safety of Pembrolizumab or Pembrolizumab Plus Chemotherapy vs Chemotherapy Alone for Patients With First-line, Advanced Gastric Cancer The KEYNOTE-062 Phase 3 Randomized Clinical Trial. JAMA Oncol. Published online September 3, 2020