Metastatik HER2 Pozitif Meme Kanserinde Şimdiye Kadar Alınan En İyi Sonuçlar
Metastatik HER2+ meme kanserinin ikinci basamak tedavisinde trastuzumab deruxtecan (Enhertu) ile görülen "olağanüstü" ve "şaşırtıcı" olarak tanımlanan yeni sonuçlar, bu ilacı tedavinin yeni standardı olarak belirlemeye aday.
Şu anda bu hastalar için standart tedavi trastuzumab emtansindir (T-DM1, Kadcyla). Kadcyla adlı kemoterapi ve hedefe yönelik antikor kombinasyonu, 2013'ten beri bu pozisyonu elinde tutuyor. Geçtiğimiz 8 yılda, kafa kafaya bir klinik araştırmada, bu ilacı yenmeye çalışan başka bir tedavi görmedik.
Şimdiye kadar…
18 Eylül’de ESMO 2021’de (Avrupa Kanser Kongresi) sunulan ve sonuçları bakımından en dikkat çeken ve heyecan veren çalışma olan DESTINY-Breast03 adlı klinik araştırmada, trastuzumab deruxtecan ve T-DM1 karşılaştırıldı.
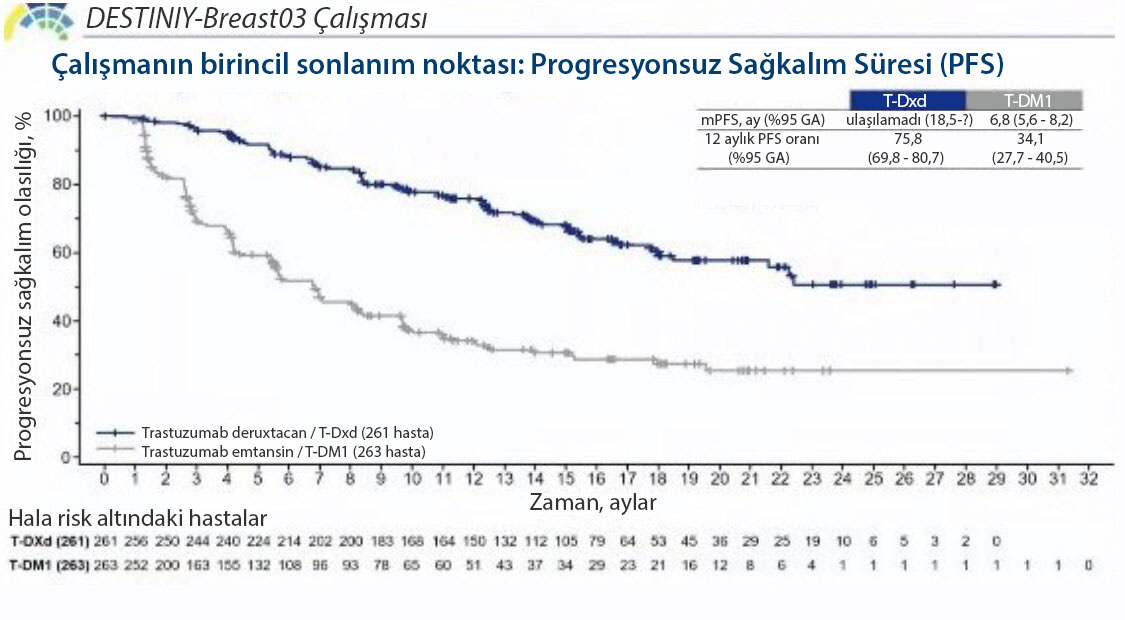
Trastuzumab deruxtecan ile ortanca progresyonsuz (ilerlemesiz) sağkalım (PFS) 25,1 ay iken, T-DM1 ile 7.2 aydı. Trastuzumab deruxtecan kullanımı, kanserin ilerleme riskini %74 azalttı (tehlike oranı [HR], 0.26).
Bu farkın "istatistiksel ve klinik olarak oldukça anlamlı" olduğu açıktır.
Ek olarak, araştırmayı sunan Dr. Sara Hurvitz, bu aşamada olgunlaşmamış olmasına rağmen, genel hayatta kalma verilerinin "cesaret verici" olduğunu da sözlerine ekledi. Öyle gözüküyor ki bu veriler trastuzumab deruxtecanın ikinci basamak HER2+ metastatik meme kanseri için yeni tedavi standardı olmasını destekliyor.
Bu ilaçların yan etki profilini "yönetilebilir" olarak görükmektedir ve iki tedavi kolu arasında "benzerdir". Bununla birlikte, trastuzumab deksruxtecan alan hastaların %45,1'inde ve T-DM1 alan hastaların %39,8'inde derece ≥3 ilaca bağlı advers olaylar meydana geldi.
Gerekçe
HER2 pozitif ileri evre meme kanserinin standart birinci basamak tedavisi, ortanca progresyonsuz sağkalım süresinin 18,7 ay olduğu CLEOPATRA çalışmasının sonuçlarına göre belirlendiği üzere, trastuzumab artı pertuzumab artı bir taksan grubu kemoterapidir.
Şimdiye kadar ikinci basamağın standart tedavisi, hastaların 9,6 aylık bir ortanca progresyonsuz sağkalıma ulaştığı EMILIA denemesi tarafından oluşturulan T-DM1 olmuştu.
Daha önce en az 2 basamak tedavi almış metastatik meme kanseri hastalarında trastuzumab deruxtecan ile yapılan faz 2 denemelerinden elde edilen önceki veriler, ortanca progresyonsuz sağkalımın iki katına hatta üç katına çıktığını gösteren güçlü aktivite ortaya çıkardı. Bu bulgular, Aralık 2019'da Enhertu’nun (trastuzumab deruxtecan) FDA tarafından onaylanmasına yol açtı (bakınız ilgili onay).
DESTINY-Breast03 Çalışmasının Detayları
Bu çalışmaya alınan hastalar, daha önce ileri/metastatik meme kanseri için trastuzumab ve bir taksan ile tedavi edilmiş, ameliyat edilemeyen veya metastatik HER2+ meme kanserine sahipti.
Hastaların yaklaşık %90'ı önceden tedavi görmüştü. Neredeyse hepsine trastuzumab verilmiş ve %60'ın biraz fazlası pertuzumab ile tedavi edilmişti.
İki tedavi kolu, temel özellikler açısından iyi dengelenmişti. Hastaların ortalama yaşı 54 idi. Yaklaşık %50'sinde hormon reseptörü pozitif hastalık, %20 ile %24 arasında beyin metastazı ve %70'inde viseral (iç organ) metastaz vardı.
524 hasta, haftada üç kez trastuzumab deruxtecan veya T-DM1 almak üzere 1:1 oranında rastgele iki koldan birine atandı.
Sonuçlar
- Araştırmacı tarafından ölçülen, trastuzumab deruxtecan ile ortanca progresyonsuz (ilerlemesiz) sağkalım (PFS) 25,1 ay iken, T-DM1 ile 7.2 aydı. Trastuzumab deruxtecan kullanımı, kanserin ilerleme riskini %74 azalttı (tehlike oranı [HR], 0.26). Bağımsız izleme komitesi tarafından ölçülen trastuzumab deruxtecana ait ortanca PFS süresine henüz ulaşılamadı.
- Trastuzumab deruxtecan ile 12 aylık PFS oranı %75,8 iken, T-DM1 ile %34,1 idi.
- Trastuzumab deruxtecan ile artan etkinlik "hormon reseptör durumu, önceki pertuzumab tedavisi, viseral hastalığın varlığı, önceki tedavi hatlarının sayısı ve beyin metastazlarının varlığı veya yokluğu dahil olmak üzere önceden tanımlanmış tüm alt gruplarda" görüldü.
- 12. ayda tahmini genel sağkalım oranı, trastuzumab deruxtecan ile %94, buna karşılık T-DM1 ile %85,9 idi (HR, 0,56; P = 0,007172). Ortanca genel sağkalıma her iki tedavi kolunda da ulaşılamadı.
- Teyit edilen genel yanıt oranı, trastuzumab deruxtecan ile %79,7 iken, T-DM1 ile %34,2 idi ( P < .0001).
- Sonuçlar ayrıca, trastuzumab deruxtecan hastalarının %16,1'inin, T-DM1 ile %8,7'sinin tam yanıt verdiğini gösterdi. Ek olarak, trastuzumab deruxtecan ile tedavi edilen hastaların sadece %1,1'inde hastalık progresyonu meydana geldi, bu oran T-DM1 kolundaki %17,5'e kıyasla.
- Ortanca tedavi süresi trastuzumab deruxtecan ile 14,3 ay ve T-DM1 ile 6,9 aydı.
Derece ≥3 ilaca bağlı advers olaylar, trastuzumab alan hastaların %45.1'inde ve T-DM1 alan hastaların %39.8'inde meydana geldi. En sık görülen olaylar nötropeni, anemi, lökopeni, trombositopeni, bulantı ve yorgunluktu.
Ciddi ilaca bağlı advers olaylar, trastuzumab deruxtecan alan hastaların %10,9'unda ve T-DM1 verilen hastaların %6,1'inde meydana geldi. İlacın kesilmesiyle ilişkili ilaçla ilgili olaylar, sırasıyla hastaların %12,8 ve %5'inde meydana geldi.
Trastuzumab deruxtecan tedavisinin kesilmesiyle ilişkili en yaygın olay, hastaların %8,2'sinde meydana gelen interstisyel akciğer hastalığı / pnömonitistir. Trombositopeni, hastaların %2,7'sinde meydana gelen T-DM1 kolundaki en yaygın nedendi.
Genel olarak, trastuzumab deruxtecan alan hastaların %10,5'inde ilaca bağlı olduğu düşünülen pnömonitis olayları meydana geldiğini, ancak olayların büyük çoğunluğunun derece 1/2 olduğunu ve sadece iki hastada derece 3 olayı olduğunu söyledi.
Tedaviye bağlı hiçbir yan etki yaşam kaybıyla ilişkilendirilmemiştir.
Trastuzumab deruxtecan daha fazla kemoterapi sağlar
Her iki ürün de antikor-kemoterapi konjugatlarıdır ve her ikisinde de HER2 reseptörüne trastuzumab bağlanır, ancak her biri kanser hücrelerine farklı bir kemoterapi verir.
Trastuzumab deruxtecan, normalde meme kanserinde kullanılmayan bir kemoterapi yüküne sahiptir ve T-DM1'e kıyasla her bir antikora bağlı iki kat daha fazla kemoterapi molekülüne sahiptir, böylece kanser hücrelerine daha fazla kemo sağlar.
Ek olarak, trastuzumab deruxtecan "parçalanabilir bir bağlayıcıya sahiptir ve bu bağlayıcı parçalandığında, bir "seyirci etkisi" üretebilen ve HER2 negaitf olanlar da dahil olmak üzere komşu hücreleri öldürebilen kemoyu serbest bırakır.
Bu, HER2+ meme kanserini tedavi etmek için özellikle önemlidir, çünkü tümörler içinde HER2+ ekspresyonunun heterojen olduğunu biliyoruz.
Trastuzumab deruxtecan ile daha önceki çalışmaların endişelerinden biri, tüm derecelerde hastaların yaklaşık %16'sında akciğer toksisitesi ortaya çıkması idi.
Bugün, bu endişelerin çoğunu bir kenara bırakabileceğimizi düşünüyorum. Mevcut denemede yüksek dereceli olaylar olmadan akciğer toksisitesini içeren daha az olay olmasının nedeninin, "önceden daha az kanser tedavisine maruz kalan hasta grubu" ile ilişkili olabilir.
Sonuç olarak, ESMO 2021’in en dikkat çekici çalışması olan DESTINY-Breast03 verileri, trastuzumab deruxtecanın ikinci basamak HER2+ metastatik meme kanseri için yeni tedavi standardı olmasını destekliyor. Bununla birlikte HER2 pozitifliği, sadece meme kanseri değil, başta mide, akciğer ve kolon olmak üzere birçok başka kanserin alt türleri için de geçerlidir. Trastuzumab deruxtecanın, HER2 pozitif diğer kanserlerde de etkili olduğuna dair yeni çalışma sonuçlarını önümüzdeki dönemde görebiliriz.
Yakın gelecekte ayrıca trastuzumab deruxtecanın meme kanserinde adjuvan, neoadjuvan ve ameliyat sonrası rezidüel (kalıntı) hastalığı olanlarda etkinliğine dair çalışma sonuçlarını göreceğiz.
1. European Society for Medical Oncology (ESMO) Annual Meeting 2021: Abstract LBA1. Presented September 18, 2021.
2. DS-8201a Versus T-DM1 for Human Epidermal Growth Factor Receptor 2 (HER2)-Positive, Unresectable and/or Metastatic Breast Cancer Previously Treated With Trastuzumab and Taxane [DESTINY-Breast03]