21. Yüzyılda Ameliyatsız Kanser Tedavilerinin ve Girişimsel Onkolojinin Geçmişi-Geleceği
Kanser ameliyatları, erken evreler için halen kanseri tam tedavi edebilecek standart tedavi yöntemi olmaya devam etmektedir. Bununla birlikte tıbbın bugünkü ve gelecek hedefi, hastanın beden bütünlüğünü ve imajını bozmadan veya çok az müdahale ederek tedavilerin uygulanmasıdır.
Ameliyatsız kanser tedavileri, kanserli hücrelerin çoğalmasını önlemeyi amaçlayan ve cerrahi müdahale gerektirmeyen veya minimal girişimlerin uygulandığı tedavi yöntemleridir. Ameliyatsız kanser tedavisi, radyoterapi, kemoterapi, immünoterapi ve minimal girişimsel farklı yöntemleri içerebilir.
Aşağıda ameliyatsız kanser tedavisine örnek olabilecek birkaç yöntemden bahsedilebilir:
- Radyoterapi: Bu yöntem, kanserli hücrelerin çoğalmasını önleyen ve büyümesini durduran ışınların kanserli dokuya verilmesini içerir.
- Kemoterapi: Bu yöntem, kanserli hücrelerin çoğalmasını önleyen ve büyümesini durduran hücre öldürücü (sitotoksik) ilaçların verilmesini içerir.
- İmmünoterapi: Bu yöntem, vücudun kendi savunma sistemini kanserli hücreleri yok etmeye yönlendirmeyi amaçlar.
- Minimal invaziv (girişimsel) onkoloji, kanser tedavisinde girişimsel yöntemlerin en az düzeyde kullanılmasını içeren bir tıbbi alandır. Bu yöntemler, cerrahi müdahalelerde cerrahi aletlerin kullanımını azaltmayı ve hastanın iyileşme süresini kısaltmayı amaçlar. Minimal girişimsel onkoloji, laparoskopik cerrahi, robotik cerrahi, endoskopik cerrahi ve girişimsel radyolojinin uyguladığı dondurma (kriyoablasyon), yakma (radyofrekans ablasyon) gibi farklı yöntemleri içerebilir.
- Laparoskopik cerrahi: Bu yöntem, cerrahi müdahale sırasında cerrahi aletlerin küçük deliklerden geçirilerek kullanılmasını içerir. Laparoskopik cerrahi, cerrahi müdahale sırasında açık cerrahiye göre daha az doku zedelenmesine neden olur ve hastanın iyileşme süresini kısaltır.
- Robotik cerrahi: Bu yöntem, cerrahi müdahale sırasında robot teknolojisi kullanılarak cerrahi aletlerin kontrol edilmesini içerir. Robotik cerrahi, cerrahi müdahale sırasında açık cerrahiye göre daha az doku zedelenmesine neden olur ve hastanın iyileşme süresini kısaltır.
- Endoskopik cerrahi: Bu yöntem, cerrahi müdahale sırasında endoskop (büyütme ve ışık verme özelliği olan bir optik cihaz) kullanılarak cerrahi aletlerin kontrol edilmesini içerir. Endoskopik cerrahi, cerrahi müdahale sırasında açık cerrahiye göre daha az doku zedelenmesine neden olur ve hastanın iyileşme süresini kısaltır.
- Girişimsel radyoloji uygulamaları: Kısaca tümörü yakarak, dondurarak veya besleyen damarı tıkayarak tahrip etmeyi amaçlayan uygulamalardır. Bu girişimler, kanserli hücrelerin çoğalmasını önlemeyi amaçlar ve genellikle cerrahi müdahale gerektirmez. Minimal girişimsel uygulamalar çoğunlukla genel anestezi gerektirmez, işlemler lokal anestezi altında uygulanır. Onkolojide girişimsel radyoloji uygulamaları arasında aşağıdakiler yer alabilir.
- Radyofrekans ablasyon (RFA): Bu yöntem, kanserli dokuyu ısıtarak yok etmeyi amaçlar.
- Embolizasyon: Bu yöntem, tümöre kan götüren atar damarların tıkanarak kanser hücrelerinin beslenmesini engellemeyi amaçlar. Embolisasyon, kanserli hücrelerin çoğalmasını önleyen ve büyümesini durduran bir tedavi seçeneğidir.
- Kemoembolizasyon: Bu yöntem, kanserli hücrelerin çoğalmasını önleyen ilaçların verilmesini ve kanserli hücrelerin beslenmesini engellemeyi amaçlar.
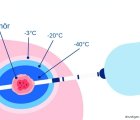
- Kriyoablasyon: Bu yöntem kanserli dokuyu dondurarak etki eder.
- Mikrodalga ablasyon: Bir mikrodalga enerji kaynağı kullanılarak bir tümör veya diğer doku anormalitesine yönelik bir tedavi yöntemidir. Bu yöntem, tümör veya diğer anormal dokunun hızlı ısıtılmasını sağlar ve bu sayede dokuyu tahrip eder.
Yazının devamında "minimal girişimsel onkolojik uygulamalar" yerine kısaca "girişimsel onkoloji" terimini kullanacağız.
Girişimsel Onkolojiye Giriş
Girişimsel onkolojinin de ameliyat, kemoterapi ve radyoterapi gibi çok sayıda malign (kötü huylu) tümörlerin lokal tedavilerinde etkisi kanıtlanmıştır.
İmmün-onkoloji (immünoterapiler), bağışıklık sistemi ve moleküller üzerinden tümörlerin kontrol edilme olasılığından doğmuş ve onkolojide çok büyük değişikliklerin ortaya çıkmasına yol açmıştır. Bu nedenle 21. yüzyılda girişimsel onkoloji hakkında immünolojiyi düşünmemek mümkün değildir. Bu da girişimsel onkolojinin şimdiye kadar ihmal edilen immünomodülatör (bağışıklık düzenleyici) etkilerine daha fazla dikkat edilmesi gerektiği ve immüno-onkoloji ile birlikte olabilecek sinerjik etkilerinin araştırılması gerektiği anlamına gelmektedir. Bununla birlikte girişimsel onkoloji ve immüno-onkolojinin kombine kullanılmasının, sınırlı bölgesel etkiler ve yüksek oranda yan etkiler gibi problemlerin üstesinden gelmeye yardımcı olması beklenmektedir. Ancak bunun için sektörel sınırlar kaldırılmalı ve disiplinler arası araştırma çabaları güçlendirilmelidir. Başarılı olunması durumunda girişimsel onkolojinin geleceği heyecan vermektedir.
Kanser Tedavisinde Girişimsel Onkolojinin Yeri
Şimdiye kadar kanser tedavilerinin asıl amacı, kanserli tümörlerin mutlak minimuma indirilmesini içermekteydi. Bu da ameliyat, kemoterapi ve radyoterapi gibi çeşitli tedavi bileşenlerini gerektirebilmektedir. Girişimsel onkoloji, son yıllarda tanısal ve girişimsel radyolojiden doğmuştur.
Girişimsel onkolojinin çeşitli teknikleri, minimal girişimsel tarzdaki “klasik” tedavilerin temel konseptlerine benzemektedir. Belirleyici kriterler, daha az yan etki ve üstün hasta toleransı beraberinde girişimsel onkoloji tekniklerinin odaksal veya bölgesel uygulamaları / etkileri ile belirlenebilir.
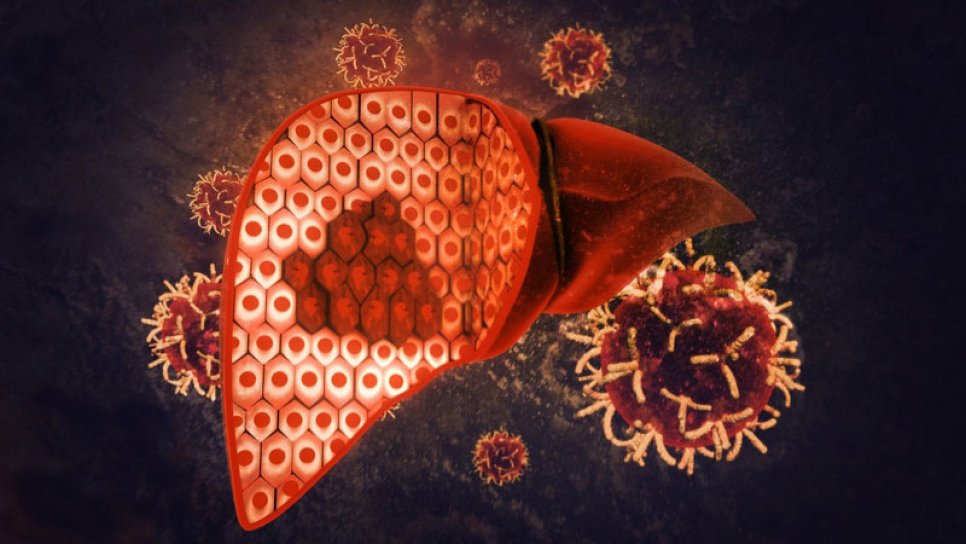
Birçok klinik durumda, girişimsel onkoloji sonuçları ameliyat ve kemoterapi ile benzerdir. Hatta erken ve bölgesel ileri evre denilebilecek hepatoselüler karsinom (HSK, en yaygın gözüken karaciğer kanseri) ve oligometastatik (az sayıda metastaz yapmış) akciğer kanseri veya erken evre böbrek kanserlerinde girişimsel onkoloji teknikleri, önceki standart tedavilere üstündür.
Sonuç olarak girişimsel onkoloji, çeşitli kanserlerde onkolojik tedavinin dördüncü kolu ve multimodalite (çok modlu) tedavi konseptlerinde genellikle problem çözücü olarak görülebilir.
Girişimsel onkoloji tedavilerinin başarısı artsa da tümörlerin tekrar etme riski hep sorun olarak kalmıştır. Görünen tüm tümörler tedavi edildiğinde dahi vücutta kanserli hücrelerin kalabilmesi mümkündür. Bu da çoklu tedavi ihtiyacına vurgu yapmaktadır.
Bununla birlikte süregelen araştırmalar, tümör biyolojisi ve kanserli hücrelerin büyümesini uyaran veya baskılayan, genellikle oldukça karmaşık/kompleks immünolojik süreçler hakkında derin bir anlayışa yol açmaktadır.
Girişimsel onkoloji de dahil olmak üzere immün-onkolojinin bu yükselişi, onkolojiyi olduğu kadar, mevcut ve gelecekteki tedavi kavramlarını da değiştirecek. Temelde, tanımlanmış bir hastalığı standart bir protokolle tedavi etme açısından "klasik" onkoloji modeli, sağlık hizmetlerinin tüm bileşenlerini bireysel bir hastaya göre özelleştiren hassas tıbba doğru evrilmektedir.
Tıbbi Onkolojik Gelişmeler
Geçtiğimiz yüzyılda onkoloji, tedavi edici amaçla bir hastalığı kovalamak anlamına geliyordu. Aynı zamanda, biyomedikal araştırmaların bulguları ve gelişmeleri, kanserin moleküler mekanizmasına dair daha fazla içgörü sağladı. Son zamanlarda ise onkolojik kontrol mekanizmalarını tanımlamak ve bunları potansiyel tedavi edici amaçlar için kullanmak / değiştirmek için çok sayıda araç geliştirildi.
Şu anda bu alanın iddialı vizyonu, kanser bir tümör şeklinde filmlerde görünür hale gelmeden önce likit biyopsiler ile tespit ve tedavi edildiği bir çağa girebilmektir. Ayrıca, kanseri tedavi etme ve iyileştirme konusundaki iddialı çabamızda, evresi ne olursa olsun, hastalık gidişatını öngörecek biyobelirteçleri tanımlamanın yanı sıra kanseri tetikleyen mutasyonları saptamak ve anlamak, bunları hedeflemek ve son olarak kanser hücrelerinin bağışıklık sistemi ile kontrolünü arttırmak da vardır.
"Klasik" kemoterapiler ve hücre metabolizmasını baskılayan tedavilerden sonra (ve bunlara ek olarak), immün-onkoloji, tıbbi onkolojinin en ileri noktası olarak kabul edilmektedir.
İlk olarak 2000 yılında Hanahan ve Weinberg tarafından önerilen kanserin ayırt edici özelikleri, yıllar içinde revize edilerek, karsinojeneze (kanser olulumuna) yol açan güncel 14 temel özellik olarak belirlenmiştir:
- Kendi büyüme faktörlerine sahip olma
- Büyüme engelleyici faktörlerden kurtulma
- Bağışıklık sisteminden kaçma
- Sürekli bölünme yeteneği
- Kanserleşmeyi destekleyen iltihaplanma (yangı = enflamasyon)
- Başka doku ve organlara göç etme (invazyon veya metastaz)
- Anjiyogenez (yeni damar oluşturma)
- Gen yapısında mutasyonlar (hatalar)
- Hücre ölüm mekanizmasını atlatma
- Enerji metabolizmasını değiştirme
- Fenotipik plastisite ve bozulmuş farklılaşma
- Mutasyonel olmayan epigenetik yeniden programlama
- Polimorfik mikrobiyom
- Yaşlanmış hücreler
Bunların çoğunun, bağışıklık sistemi süreçleriyle bağlantılı olma ve kanserin bağışıklık sistemini değiştirme olasılığı yüksektir. Biyolojik tedavilerdeki bu yaygın umut (ve bazen tuzak) muazzam araştırma çabaları ile desteklenmektedir.
İmmüno-onkolojik Devrim
Yakın bir tarihte yapılan "Nature Reviews" analizinde, dünya çapında şu anda neredeyse 5200 aktif deney ile birlikte 2017 – 2019 yılları arasında yalnızca bağışıklık (immün) ilacı geliştirmede %92’lik bir artış olduğu ortaya kondu.
Tablo 1. Günümüzde, birkaç alt kategorisi ile ana immünoterapi çeşitleri aşağıda sıralanmıştır
| Kategori | Tipi | Etken madde | Hedef | Kanser türü | |
| Pasif | Hedefe yönelik antikorlar | Monoklonal antikorlar | Bevasizumab, Setüksimab, Denosumab, Panitumumab, Rituksimab, Trastuzumab... | CD20/33/52, VEGFA, EGFR, Her2, RANK | Lösemi, lenfoma, meme, akciğer, kolorektal, böbrek kanserleri, glioblastom |
| Antikor-ilaç konjugatı | Ado-trastuzumab, brentuksimab |
Her2+ CD30 |
Meme, lösemi, lenfoma |
||
| Bispesifik antikorlar | Blinatumomab | Lösemi | |||
| Sitokinler | İnterferon, interlökin | ||||
| Aktif | Bağışıklık düzenleyiciler | Adoptif hücre transferi (canlı hücre tedavileri) | TIL, CIK hücreler, CAPRI hücreler, TCR hücreler, CAR T-hücreler, NK hücreler | EBR2 MART-1 CD19 |
Safra yolu kanseri, lösemi, lenfoma |
| Kontrol noktası inhibitörleri | Ipilimumab, nivolumab |
CTLA-4 PD-1 |
melanom, akciğer, böbrek | ||
| Aşılar | Peptid aşıları | Onkofaj | Böbrek | Böbrek | |
| Dentritik hücreler | Sipuleucel-T | GM-CSF | Prostat | ||
| Allojenik tüm hücre aşıları | CD4, CD8 | Melanom, pankreas, meme | |||
| Onkolitik virüsler | T-vec | Melanom |
CD, farklılaşma kümesi; CTLA, sitotoksik T-lenfosit ile ilişkili protein; EGFR, Epidermal Büyüme Faktörü Reseptörü; GM-CSF, Granülosit-makrofaj koloni uyarıcı faktör; HER2, insan epidermal büyüme faktörü reseptörü 2; MART, T hücreleri tarafından tanınan melanom antijeni; PD, programlanmış ölüm; PD-L, programlanmış ölüm ligandı; VEGFA, Vasküler endotelyal büyüme faktörü A.
İmmünoterapiler için Temel Terimler
Monoklonal antikorlar (mAB’ler)
- Belirli bir hedef (kanser hücresinin yüzeyindeki bir protein) için laboratuvar mühendisliği ile yapılan, bağışıklık yanıtını arttıran, kanser hücrelerini öldüren veya büyümelerini durduran monoklonal antikorlar (mAB’ler) ile tedavi.
İmmün sistemi düzenleme
- Bir ilacı veya radyoaktiviteyi belirli bir hücreye taşımak için kullanılan konjuge mAB’ler tedavi.
- Aynı anda iki proteine bağlanan iki antikor bileşeninden oluşan bispesifik mAB’ler ile tedavi.
-
Belirli mAB'ler (kontrol noktası inhibitörleri), tümör hücrelerini bağışıklık sistemi için "görünmez" hale getiren kontrol noktası proteinlerini (örn: PD-1 ve PD-L1) bloke eder ve bağışıklık sürecini tekrar serbest bırakır.
Tümör agnostik (kanserin köken aldığı organdan bağımsız) tedaviler
- Kanser hücrelerinin neden olduğu mutasyonları hedef alan ancak kanserin kaynaklandığı organa göre tümör hücrelerini hedef almayan mAB'ler ile tedavi, ki bu da bu mutasyonları içeren bir kanserin de hedef alınacağı anlamına gelir.
- Sitokinler, spesifik olarak kanser hücrelerini hedeflemeden bağışıklık sistemini uyaran interferonlar ve interlökinler olarak sıklıkla kemoterapi veya radyoterapi ile birlikte uygulanır.
Adoptif T-hücre tedavisi
- T hücrelerini vücut içinde çoğaltmak için kansere özgü T hücrelerinin izolasyonu ve laboratuvar ortamında büyümesini içeren tedavidir.
- Vücut içinde kanserli hücrelerin yok edilmesini desteklemek için laboratuvar ortamında modifiye edilen tümör infiltre edici lenfositler (TIL'ler) ile tedavi.
- Antijen bağlama ve T hücresi aktivasyonunu birleştiren yapay bir T hücresi reseptörü üretmek için genetik olarak tasarlanmış kimerik antijen reseptörü (CAR) T hücreleri ile tedavi.
Kanser aşıları
- Kanser hücrelerinin gelişmesini önlemek için önleyici aşılar.
- Bağışıklık sistemini tümör hücrelerine saldırması için uyaran tedavi edici aşılar.
Onkolitik virüs aşıları
- Bağışıklık yanıtını uyaran antijenlerin ikincil bir salınımı ile kanser hücrelerini hedef alan ve öldüren genetiği değiştirilmiş virüs aracılığı ile yapılan onkolitik virüs tedavisi.
İlgili konu: 23 Yıllık Meme Kanserini Durduran Yeni Bir Kanser Aşısı Dikkat Çekti
Çok sayıdaki deneylerden de bilindiği gibi, bu tedavilerin çoğu, bazen sadece in vitro (laboratuvar ortamında) olmak üzere sınırlı yanıtlar üretmektedir. Bu nedenle, belirli bir hasta için kişiselleştirilmiş çeşitli yöntemleri ("kişiselleştirilmiş tedavi") birleştirerek giderek daha karmaşık kişiselleştirilmiş rejimlerin ortaya çıkması beklenmektedir.
Bu rejimler, uygun hastaları ve uygun tedavi bileşenlerini tanımlayan seçici genetik ve immünolojik analize dayanacaktır. Bu tedavileri daha da ilerletmek için, daha büyük biyopsi parçalarına (hücre ve doku örneklemelerine) ihtiyaç vardır. Özellikle sıvı biyopsilerin genel kullanımı (örn: kan gibi vücut sıvılarından katı olmayan probların örneklenmesi ve bunların örneğin dolaşımdaki tümör hücreleri, DNA ve RNA bileşenleri veya diğer çeşitli biyobelirteçler açısından analiz edilmesi) onkoloji alanında da geliştirilecektir.
Ayrıca, örneğin kontrol noktası inhibitörü sınıfından immünoterapilerin kullanıldığı tedavilerde mevcut deneyimler, etkili bir tedavi için tümör mikroçevresinin çok önemli olduğunu göstermektedir. İmmünoterapi veya akıllı ilaçlar gibi yeni nesil tedavilere uygun hastalar, DNA, RNA ve kalıtsa DNA dizilimi testleri ile tanımlanabilmektedir ve sonuç olarak, hedef doku(lar)ın görüntü kılavuzluğunda biyopsileri, daha da kritik hale gelecektir.
Kuşkusuz tüm bunlar, kulağa gerçek olamayacak kadar iyi gelebilir, ki bu da biyolojik mekanizmaları anlayarak hemen hemen her sorunun ve komplikasyonun çözülebileceğini düşündürür – 100 yıl önce nükleer fiziğin nasıl algılandığına benzer şekilde. Bununla birlikte, kanser biyolojisindeki anlayışımızın artması, görünüşte biyolojik mekanizmaların karmaşıklığı ve bunların karşılıklı ilişkileri hakkındaki artan bilgimizle örtüşmekte, ancak elbette daha da karmaşık mekanizmaların ve potansiyel yan etkilerin keşfedilmesine de yol açmaktadır.
Şu an itibariyle, sürekli gelişmekte olan moleküler tedavilerin yetenekleri ve riskleri hakkında yalnızca sınırlı veriler mevcuttur. Hastaların yalnızca küçük bir alt grubu bu pahalı bağışıklık tedavilerine erişse ve bunlardan fayda sağlasa da doğru hasta ve doğru zaman için doğru tedavileri (hatta bunların kombinasyonları) bulmak hala en büyük önceliğimizdir. Özellikle bu bağlamda, büyük veri analizleri ve yapay zekâ uygulamaları, uygun hedefleri belirlemeye, doğru immünolojik araçların seçimini optimize etmeye ve etkili bir tedavi sonucunu tahmin etmeye yardımcı olabilir.
Tıbbi Onkolojinin Geleceği
Her şeyden önce söylememiz gereken şu ki, 21. yüzyılda da onkolojinin büyük tutkusu hala kanser hastalarını iyileştirmek olmaya devam etmektedir. Bu hedef, immün-onkoloji ve ona bağlı bilimlerin sürekli olarak moleküler bazda karsinojenezin biyolojik mekanizmalarını deşifre etmesi, anlaması ve değiştirmesi sayesinde daha ulaşılabilir hale gelmektedir.
Dünya genelinde her yıl yaklaşık 20 milyon kanser tanısı konuyor ve kanserlerin yarıdan azı halen tam olarak tedavi edilemiyor, yine de hastanın tümörünün genetiğine özel seçilmiş immünoterapiler ve bağışıklık sistemini düzenleyen diğer sistemik ve/veya lokal tedaviler, bir kanserin kontrol altına alınmasına önemli ölçüde katkıda bulunabilir. Elde edilebilecek en iyi yaşam kalitesi açısından “iyileşme”, o zaman vücutta hala zararsız olacak şekilde kontrol edilen tümör hücreleri olması, yani kanserin “kronik” bir hastalığa dönüşmesi ve “kanser konakçısının” önemli bir hasar yaşamaması olarak yorumlanabilir.
İlgili konu: Neden Kanserler Tamamen Tedavi Edilemedi?
Girişimsel Onkolojinin Kısa Tarihi – Geçmiş ve Şu An (İlk 30 – 40 yıl)
Altta yatan tekniklere ve klinik uygulamalara ilişkin devam eden gelişmeler, girişimsel onkolojiyi karaciğer, akciğer, böbrek veya kemik gibi birincil (primer) tümörlerin ve metastazlarının tedavisinde oldukça etkili bir bileşen haline getirmiştir. Girişimsel onkoloji, sistemik yan etkilerin olmaması veya çok hafif yan etkilerin ortaya çıkmasıyla karakterize edilir ama dahası bunu "klasik" cerrahi (ameliyat), medikal ve radyasyon onkolojisi ile birleştirme yeteneği ile karakterize de edilmektedir.
Ameliyat, kemoterapi veya radyoterapi gibi yerleşik tedavi kavramlarının temel ilkelerini uygulayan ve şimdiye kadar zaten bir tür bireyselleştirilmiş tedaviyi temsil etmekte olan girişimsel onkoloji teknikleri, esas olarak lokal veya bölgesel bir tarzda hareket etmektedir.
Erişim yolu ve tedavi uygulamasına göre Girişimsel Onkoloji teknikleri, transvasküler ve perkütan teknikler olarak gruplandırılmaktadır (Tablo 2).
Tablo 2. Erişim (tümöre uygulama) yoluna, tedavi sunumuna ve spesifik etki mekanizmasına göre girişimsel onkoloji teknikleri
| Erişim/Uygulama yolu | Ablasyon tekniği | Etki Mekanizması | Hedef |
|
Transarteriyel (intraarteryel) |
Kemoterapi | Hepatik arter infüzyonu (HAİ) TAKE (klasik,+yumuşak boncuklar,+ilaç salan boncuklar) Kemosatürasyon |
Karaciğer: lokal, bölgesel ileri (örneğin , süper seçici, seçici lober veya segmental tüm karaciğer) |
| Radyoterapi | TARE | Karaciğer: lokal, bölgesel ileri (örneğin süper seçici, seçici lober veya segmental, radyorezeksiyon) | |
| Transkütanöz (deriden geçerek) | Isı ile ablasyon | Radyofrekans (RFA), mikrodalga (MWA), kriyoablasyon, LITT | Karaciğer, akciğer, böbrek, lenf düğümü, kemik, yumuşak doku |
| Elektromekanik | IRE (nanoknife), HIFU (ultrasonla) | Az sayıda kanser türü (sınırlı endikasyon) |
HAI, hepatik arteriyel perfüzyon; HiFU, yüksek odaklı ultrason; IRE, geri döndürülemez elektroporasyon; LITT, lazer kaynaklı termoterapi; MWA, Mikrodalga ablasyonu; RFA, radyofrekans ablasyonu; TAKE, transarteriyel kemoembolizasyon; TARE, transarteriyel radyoembolizasyon.
Ameliyatla çıkarılamayan HSK (hepatoselüler karsinom, karaciğer kanseri) için ilk girişimsel onkoloji tekniği transarteriyel kemoembolizasyon (TAKE) 1977'de Yamada ve arkadaşları tarafından tanıtıldığında, dünya çapında HSK için son teknolojik tedavi olarak kabul edildi. Son yıllarda orijinal, lipiyodol bazlı tekniğin çeşitli iyileştirmeleri ve düzenlemeleri geliştirilmiştir. Mevcut gelişmeler, daha ayrıntılı embolizasyon tekniklerine dönüşen tümör içi ve tümör çevresi akış dinamiklerinin artan farkındalığı ile daha seçici ve süper seçici bir uygulamaya yönelmektedir.
Hala standardizasyondan uzak olan TAKE'nin mevcut meta-analizleri, erken ve bölgesel ileri evre HSK vakaları için yaklaşık %15-30'luk 5 yıllık sağkalım oranlarını ortaya koymaktır, oysaki son yıllarda DEB-TAKE ile daha iyi sonuçlara yönelik bir eğilim görülmektedir.
Ayrıca karaciğere metastaz yapmış kanserlerde – örneğin metastatik kolorektal kanser (mKRK) için belirgin kanıtlar ile – 5-florodeoksiüridin (FUDR), 5-florourasil (5FU) ve oksaliplatin ile hepatik arter infüzyonu (HAI) gibi transarteriyel perfüzyon teknikleri onkologlar arasında büyük ilgi görmüştür. Ameliyatla çıkarılamayan karaciğer metastazlarında, HAI ve sistemik kemoterapinin kombinasyonu, tek başına sistemik kemoterapinin %40-50'sine kıyasla, %70-85'lik 5 yıllık ortanca sağkalım oranları sağlamaktadır.
HAI'nin özel bir "versiyonu" perkütan kemosatürasyon, ameliyatla çıkarılamayan karaciğerin primer (kendi) tümörleri veya diğer organ kanserlerinin metastazları için yenilikçi bir girişimsel onkoloji uygulamasıdır. Bu sistem, ilacın büyük oranda karaciğerde kalmasını sağlar; yüksek dozda kemoterapötik ajan melfalan doğrudan karaciğere verilir. Hala yalnızca seçilmiş merkezlerde ara sıra uygulanan bu teknik, şimdilik ileri evre over (yumurtalık) kanseri, miyelom ve melanoma için tercih ediliyor, diğer kanserlerde ise etkinliği netlik kazanmadı. Bu nedenle, bu tekniğin büyük bir klinik etki kazanıp kazanmayacağını gelecek gösterecektir.
TAKE'nin bir "brakiterapi varyantı" olarak itriyum-90 ile transarteriyel radyoembolizasyon (TARE), son yıllarda tartışmalara neden olmaktadır. HSK ve mKRK için birinci basamak tedavi olarak TARE, sistemik tedavilerle kombine TARE ve tek başına sistemik tedavileri karşılaştıran yeni, geniş, çok merkezli randomize kontrollü klinik çalışmalar, beklentilerin aksine, karşılaştırılan tedavilerin esas olarak eşdeğerliğini sağlamıştır. Bununla birlikte, çok sayıda çalışma, primer ve metastatik hepatik tümörlerde itriyum-90'ın çok yönlülüğünü ortaya koyabilmiştir.
Yakın zamanda ortaya çıkan Holmium-166 bileşiği, radyasyon özellikleri açısından itriyum-90'a kıyasla bazı pratik özelliklere sahip olabilmektedir, ancak etkinliği henüz klinik olarak tespit edilmemiştir.
Farklı perkütan termal ablasyon (ısı ile tahrip etme) teknikleri arasında ilk olarak 1988 yılında radyofrekans ablasyon uygulanmıştır. Soğutmalı sistemler, mikrodalga ablasyon, darbeli enerji dağıtımı vb. gibi teknik gelişmeler ve yeni gelişmeler, termal ablasyonu iyi bilinen endikasyonları ve mükemmel belgelenmiş sonuçları olan çok sağlam bir teknik haline getirmiştir.
Kriyoablasyon, geri dönüşümsüz elektroporasyon ve yüksek yoğunluklu odaklanmış ultrason gibi diğer ablatif teknikler ise hala araştırmaktadır. 1990’lara dayanan kriyoablasyon, şu anda esas olarak renal hücre kanseri ve kemik tümörleri için kullanılmaktadır. Ablasyon sırasında daha az ağrı ve MRG (manyetik rezonans görüntüleme) uyumluluğu gibi bazı faydalarına rağmen, kriyoablasyonun diğer tekniklerden birine göre kanıtlanmış bir üstünlüğü yoktur.
Nanoknife (geri dönüşümsüz elektroporasyon) ve HIFU (yüksek yoğunluklu odaklanmış ultrason) ise ilk çıktığında büyük beklentiler yaratmıştır. Ancak şu anda mevcut olan verilere göre, her ikisinin de klinik ihtiyaçlar için pek uygun olmadığı görülmüştür.
Destekleyici Teknikler
Bilgi teknolojisindeki [yapay zekâ (YZ), artificial intelligence (AI)], büyük veri, akıllı algoritmalar ve robotiklerle makine ve derin öğrenme) muazzam ilerleme sadece günlük hayatı etkilemekle kalmıyor, aynı zamanda gelecekte tıbbın nasıl uygulandığını da önemli ölçüde değiştirecek. Özellikle onkolojide, tıbbi veri tabanlarının ve örn. kan veya tümör örneklerinden elde edilen genomik bilgileri gibi bireysel hasta verilerinin analitik olarak bağlanması, tanı ve tedavi kararlarını destekleyecektir.
Hastalık ve tedavi yöntemleri yapay zekâ ile daha çok desteklenmeye devam edecektir.
Ultrason ve MRG’ye dayalı füzyon görüntüleme teknikleri ve muhtemelen dielektrik veya optik görüntüleme birçok yeni teknik olarak gelişmiş görüntüleme teknolojileri, YZ ve hatta artırılmış ve sanal gerçekliği içeren robotik destekli görüntülemeler / uygulamalar, hasta ve operatörün radyasyona minimal düzeyde maruz kaldığı son derece hassas girişimsel onkoloji prosedürlerine izin verecektir.
Kristal Küreden 21. Yüzyıla Bakalım
20. yüzyılda 21. yüzyılı hayal etmiş olsaydık, ultrason, tomografi, MRG, kateter bazlı işlemler muhtemelen hiç kimsenin aklının ucundan bile geçmezdi.
Fourier dönüşümü 1805'te tanımlandı, X-ışınları 1895'te tespit edildi, neredeyse 80 sonra ilk Bilgisayarlı Tomografi tanıtıldı – tabii ki de Fourier dönüşümü olmadan bu mümkün olmazdı. 1925'te Wolfgang Pauli elektron dönüşünü öne sürdü ve sonrasında ilk MRG tarayıcısının geliştirilmesi 50 yıl daha sürdü. Son olarak, ilk sağ kalp kateterizasyonu (kalp anjiosu) 1924'te Werner Forssmann tarafından yapıldı, sonra unutuldu ve yeniden icat edildi, 1977'de Andreas Gruentzig tarafından ilk balon anjiyoplasti (balonla damar açılması) olarak teknik geliştirildi. Bugün onkolojinin kaderini değiştiren immün kontrol noktası baskılayıcı immünoterapilerin temelleri ise 1990'da James Allison'un CTLA-4'ü keşfetmesi ile atıldı...
Önümüzdeki on yıllar boyunca, daha da hızlı dönen bir bilgi çarkı düşünmeliyiz ve gelecekteki birçok çarpıcı gelişmenin temellerinin çoktan atıldığını varsaymalıyız.
Kuşkusuz, tüm onkolojik tedaviler son yıllarda muazzam bir şekilde ilerledi ve 21. yüzyılda daha da fazla ilerleyecektir. Bununla birlikte, önümüzdeki on yıllar onkolojik hastaların hizmetinde belirli yeni zorluklar da sağlayacaktır. Bu zorluklar, temel olarak dünyadaki demografik ve ekonomik gelişmelerden kaynaklanabilir. Doğu ve batının çok iyi gelişmiş birçok ülkesinde, yaşlanan nüfus, yaşamları boyunca ve daha ileri yaşlarda muhtemelen birkaç kansere yakalanan, tıbbi açıdan iyi "bakımlı" insanlar sağlayacaktır.
Bu nedenle, çeşitli ek hastalıkları olan yaşlı kanser hastalarını ve farklı sağlık sistemleri içinde geri ödenebilirliği dikkate alan tedavi konseptlerine ihtiyaç duyulacaktır. Daha fakir, daha az gelişmiş ülkelerde, genellikle hızla artan nüfusa sahip ülkelerde, asıl zorluk yeterli sağlık hizmeti sağlayamamak olacaktır. Örneğin bulaşıcı hastalıklar gibi onkolojik hastalıkların oranı, daha zengin ülkelere göre daha düşük olabilirken, kanserler daha ileri evrelerde tanı alabilir.
Tıp bilgisi sürekli değişece-gelişecek, mevcut tedaviler ve uygulamalar geçmişte olduğu gibi ortadan kalkacak ve yerini yenileri alacaktır. Elbette, her açıdan artan sayılar ile tıp dünyasının daha da karmaşık hale geleceğini tahmin etmek aşağıdaki nedenlere bağlı olarak zor değil;
- Ek hastalıkları nedeniyle kişiselleştirilmiş tedavilere ihtiyaç duyan daha fazla ve daha yaşlı hasta nüfusu
- Sağlığa ekonomi baskısı (Covid-19 Pandemisi sırasında görüldüğü gibi)
- Ayakta tedavi ve kısa süreli yatışlarda “hasta konforu” için artan gereksinim
- Başta bağışıklık temelli olmak üzere daha fazla ilaç
- Yeni kanıtlar ve büyük olasılıkla beklenmedik bağlantılar üreten akıllı algoritmalar tarafından işlenen daha fazla tıbbi veri
- Hastalığın daha erken saptanmasına vb. izin veren implante edilebilir cihazlarla ("nano makineler") kendi kendine optimizasyon ve otomatik tanı için siber teknolojiler
Ayrıca, çeşitli ulusal ve uluslararası kanser tedavi kılavuzlarındaki (ESMO, ECCO, EASL, ASCO-NCCN) birçok güncel tavsiyeye göre, onkolojik tedavinin felsefesi, kişiselleştirilmiş tedavi yaklaşımlarına doğru değişim gösteriyor. Bununla birlikte, tümörün tamamen temizlenmesi hala hedef olmaya devam ediyor. Esas olarak iç karartıcı bir tanıyı, uzun süreli tedavilerle kontrol edilen kronik bir hastalığa dönüştürmek, hastanın yaşam kalitesini yüksek bir seviyede ve ilgili tümör yükünü düşük bir seviyede tutmak için yeterli-ideal tedavi hedefleri olabilir. Sınırlı kaynaklara ve ekonomik yeteneklere sahip senaryolarda, bu kavramlar makul, kabul edilebilir ve karşılanabilir olabilir.
Hareketli Bir Hedef Olarak Kanser
Ayrıca, çeşitli açılardan hareket eden bir hedefle uğraşıyoruz. Hepsi olmasa da çoğu tümör, zaman içinde genomik, mikro ve makrobiyolojik davranışlarını değiştirebilirken, tümörü barındıran hasta da yaş, ek hastalıklar ve ayrıca belirli bir tedaviye direnç ve psikolojik kabul açısından değişim göstermektedir.
Hassas tıp, bu sorunların çoğunu ele almaktadır. Bununla birlikte, şu anda genom ayarlı hassas tıp (gen düzenleme, tümöre özgü kanser aşıları, CAR T-hücre tedavisi), hastaların yalnızca küçük bir kısmı için uygundur, hala çok maliyetli ve genellikle hastanın toleransını sınırlayan ciddi yan etkilere sahiptir.
Her ihtimalde, tümöre karşı belki daha iyi bir bağışıklık sistemi kontrolü, gelecekte tedavilerin nasıl gerçekleştirileceğini önemli ölçüde etkileyecektir. Ancak immün-onkoloji, önce laboratuvar ortamında sonra gerçek hastada tümörü tamamen ortadan kaldırmadığı sürece, onkolojinin minimal invaziv ayağı olarak cerrahi, radyasyon tedavisi, kemoterapi ve girişimsel onkoloji için güçlü bir talep olmaya devam edecektir.
Girişimsel Onkolojiyi Bekleyen Zorluklar
Şu anda, immünoterapiler, hedefe yönelik akıllı ilaçlar, hormonal terapiler, bunların kombinasyonları ve sonuç olarak hassas tıp nedeniyle girişimsel onkoloji, çoğu onkoloji profesyonelinin ana odak noktasında değil. Örneğin, ABD Ulusal Kanser Enstitüsü’nün web sitesinde, listelenen sekiz kanser tedavisi türü (yani cerrahi, radyasyon tedavisi, kemoterapi, immünoterapi, hedefe yönelik tedavi, hormon tedavisi, kök hücre nakli ve hassas tıp) arasında girişimsel onkolojiden bahsedilmiyor bile – iyi niyetli olarak girişimsel onkolojinin "hedefe yönelik ve hassas tıp" kapsamına girdiği varsayabiliriz.
Girişimsel onkolojinin geleceği hakkında birkaç yıldan fazlasını tahmin etmek, kristal küreden fal bakmak gibi olabilir.
Yine de bazı eğilimler ve geçmişten alınan dersler, girişimsel onkolojinin nereye gidebileceği ve hangi engellerin aşılması gerektiği konusunda bir fikir edinmemize yardımcı olabilir
Son yıllarda girişimsel radyoloji, çeşitli girişimsel onkoloji tekniklerinin etkinliğine ilişkin kapsamlı bir kanıt tabanı oluşturmuştur. Özetle, girişimsel onkoloji tekniklerinin yeteneklerine uygun sınırlı bir tümör boyutu, birçok organdaki çeşitli kanser türlerinde cerrahi veya radyasyon tedavisine benzer şekilde etki ile tedavi edilebilir.
Daha önce belirtilen sinerjistik etkilerin yanı sıra görüntüleme, rehberlik ve tedavi yetenekleri ile girişimsel onkoloji, her türlü onkolojik ve immün-onkolojik tedaviye çok yönlü katma değer sunabilir. Bu katma değer, karmaşık görüntüleme analizine dayanan esas tümör karakterizasyonu için genellikle teknik olarak kolay, son derece hassas doku örnekleme uygulamalarından en yüksek hassasiyetle perkütan veya transvasküler tedavilere kadar uzanır. Özellikle hassas lokal ilaç/molekül iletimi, daha az sistemik toksisite ile bölgesel iyileştirilmiş dağılım ve konsantrasyon açısından sistemik uygulamaların sınırlarını aşabilir.
Görüntü rehberliği ile yapılan tedavilerle ilgili olarak girişimsel onkoloji, görüntüleme ve görüntüleme tabanlı veri işlemedeki yapay zekâ odaklı gelişmelerden önemli ölçüde faydalanacaktır.
Gelişmiş medikobiyolojik bilgiler ile yeni tedaviler üretilecek, teknik gelişmeler ile yeni uygulamalar geliştirilecek ve her ikisi için de girişimsel onkoloji uygulamaları yeni ihtiyaçlar ve fırsatlar yaratacaktır. Disiplinler arası çalışmaların hala büyük bir başarı olarak görüldüğü günümüzde de olduğu gibi bu uygulamanın hala farklı tıbbi uzmanlık alanlarında görülüp görülmeyeceği belirsizdir.
Gelecek nesil tıp uzmanları, mühendisler ve yöneticiler geleneksel tıbbi kategorilerden ve farklı uzmanlıklardan ne kadar uzaklaşırsa, hastalık sistemi ile ilgili uzmanlıkları ve becerileri birleştirebilecek yeni tıbbi hizmet yapıları gelişebilir.
Sonuç
İmmünolojik tedaviler 21. yüzyılda büyük olasılıkla onkolojiye hâkim olacak gibi gözüküyor. Ancak gen düzenleme, canlı hücre aşıları gibi ileri immüno-onkolojik ve genetik tedaviler, şimdiye kadar yalnızca belirli kanser türlerinde, yüksek maliyetle ve ciddi yan etki potansiyeli ile etkileyici başarılar göstermiştir.
Öte yandan girişimsel onkolojik yöntemler, farklı tümör tiplerinde bölgesel tümör kontrolü ve düşük yan etkiler açısından etkinliklerini zaten açıkça kanıtlamıştır, ancak önceden bilinen immünomodülatör etkileri genellikle önemli sistem-terapötik etkiler elde etmek için çok düşüktür.
Girişimsel onkoloji ve immüno-onkolojinin kombinasyonunun, sinerji yoluyla bu sınırlamaların üstesinden gelme olasılığını vardır. Ancak bu, sektörel düşünceyi geride bırakmayı ve hasta için en iyi tedaviyi bulma hedefine odaklanmayı gerektirmektedir.
Buradaki önemli bir adım da rekabet eden uzmanlıklar arasında karşılıklı bilgi alışverişini teşvik etmek ve araştırma çabalarını mümkün olduğunca kapsamlı bir şekilde bir araya getirmek için girişimsel onkolojinin disiplinler arası varlığını güçlendirmektir. Bu nedenle, geniş bir yelpazede harika araçlara ve konseptlere sahip olan girişimsel onkolojinin geleceği parlak olabilir ve girişimsel onkolojinin 2. çağı başlayabilir.
Helmberger, T. (2020). The evolution of interventional oncology in the 21st century. The British Journal of Radiology, 93(1113), 20200112.