Glioblastoma multiforme tedavisi için yeni bir seçenek: Regorafenib
Glioblastom erişkinlerde en sık görülen malign beyin tümörüdür. GBM, GBM-IV, glioblastoma multiforme veya 4. derece beyin tümörü olarak da adlandırılır. Yeni tanı konan glioblastom için standart tedavi, kanserli dokuyu olabildiğince çıkaran bir beyin tümörü ameliyatını takiben temozolomid adlı kemoterapi ile adjuvan kemoradyoterapidir. Bu yaklaşıma rağmen, glioblastom 24 aydan daha az bir medyan (ortanca) genel yaşam süresi ile ilişkilidir ve nüks (kanser tekrarı) kaçınılmazdır.
GBM tekrarladıktan sonra hangi tedavilerin uygulanması gerektiği net değildir ve bu durumda uygulanan tedavilerin etkinlikleri zayıftır. Bu durum için bir nitrozüre sınıfı sentetik DNA alkilleyici madde olan lomustin, tekrarlayan glioblastomlu hastalarda faz 2 ve 3 klinik araştırmalarda yaygın olarak kullanılmıştır.
Glioblastom, anjiogenezin (yeni damar oluşumunun) en yoğun olduğu tümörlerden biridir ve VEGF reseptörü üzerinden yeni damar oluşumunu baskılayan bir antikor olan bevasizumab, ilerleyen veya tekrarlayan glioblastom için FDA onaylıdır. Bununla birlikte, tek başına veya kemoterapi ile birlikte bevasizumab, glioblastom için birinci veya ikinci basamak tedavi olarak genel sağkalımı uzatmamıştır.
Tekrarlayan glioblastomlu hastaların tedavisinde lomustin + bevasizumab ile tek başına lomustini karşılaştırılan 26101 adlı faz 3 çalışmada, lomustine bevasizumab eklenmesi progresyonsuz (ilerlemesiz) sağkalımda bir iyileşme göstermesine rağmen, genel sağkalımda anlamlı bir katkı göstermedi.
Glioblastomun, yeni damarlanmanın yoğun olduğu bir kanser türü olduğunu yukarıda belirtmiştik, fakat bu kanserde anti-anjiyojenik bir ilaç olan bevasizumaba hızlı direnç gelişmektedir. Bu nedenle yeni damarlanmaya karşı etkili başka ajanlar araştırılmaktaydı. Bu ilaçlardan biri regorafenib idi.
Not: Regorafenib, tümör anjiyogenezinde (VEGFR1-3 ve TIE2), onkogenezde (TIT, RET, RAF1 ve BRAF genleri), tümör mikroçevresinde (trombosit kaynaklı büyüme faktörü reseptörü [PDGFR]) ve fibroblast büyümesinde rol oynayan, oral (ağızdan hap şeklinde) alınan, tirozin kinaz inhibitörü sınıfından bir kanser ilacıdır. Regorafenib (Stivarga), ABD Gıda ve İlaç İdaresi (FDA) ve Avrupa Tıp Ajansı (EMA) tarafından metastatik kolorektal kanserlerin, gastrointestinal stromal tümörlerin ve hepatoselüler karsinomun (karaciğer kanseri) tedavisi için monoterapi (tekli tedavi) olarak onaylanmıştır.
Klinik öncesi bir çalışmalarda, regorafenibin glioblastom tedavisi için antitümör aktivitesi gösterilmişti. Ayrıca, lapatinib ile birlikte regorafenib, insan glioblastom hücrelerine karşı aktivite göstermiştir. Regorafenib ayrıca bir faz 1 çalışmasında, glioblastomlu bir hasta da dahil olmak üzere ileri evre kanserli hastalarda setuksimab ile kombinasyon halinde klinik kullanımda faydalı olabileceğini düşündürdü. Bu özelliklere ve preklinik sonuçlara dayanarak, yazımızın konusu olan randomize, karşılaştırmalı, çok merkezli REGOMA faz 2 çalışması, tekrarlayan glioblastomlu hastaların tedavisinde regorafenibin etkinliğini ve güvenliğini araştırmak için tasarlandı. Çalışmanın ölçmek istediği birincil sonlanım nokta analizi, 78 ölüm bildirildiği 7 Temmuz 2017 tarihinde yapıldı ve 8 Eylül 2017 tarihinde Avrupa Tıbbi Onkoloji Derneği (ESMO) kongresinde sunuldu. 3 Aralık 2018 tarihinde Lancet Oncology adlı dergide ise çalışmanın nihai sonuçları sunuldu.
REGOMA faz-2 klinik çalışmasının tasarımı
- Randomize, çok merkezli, açık etiketli bu faz-2 araştırmaya İtalya'dan 10 merkez katıldı.
- Glioblastom ameliyatı ve adjuvan kemoradyoterapi sonrası kanseri tekrarlayan hastalar 1:1 oranında rastgele, eşit sayıda iki gruba ayrıldı; bir gruba günlük 160 mg regorafenib her 4 haftalık döngüde 3 hafta, diğer gruba lomustin 110 mg/m2 dozunda her 6 haftada bir uygulandı. Tedaviler hastalıkta progresyon (ilerleme), yaşam kaybı, kabul edilemez yan etki olana kadar devam etti.
- Çalışmanın ölçmek istediği ana sonlanım noktası genel sağkalım süresi olarak kabul edildi.
Çalışmanın sonuçları
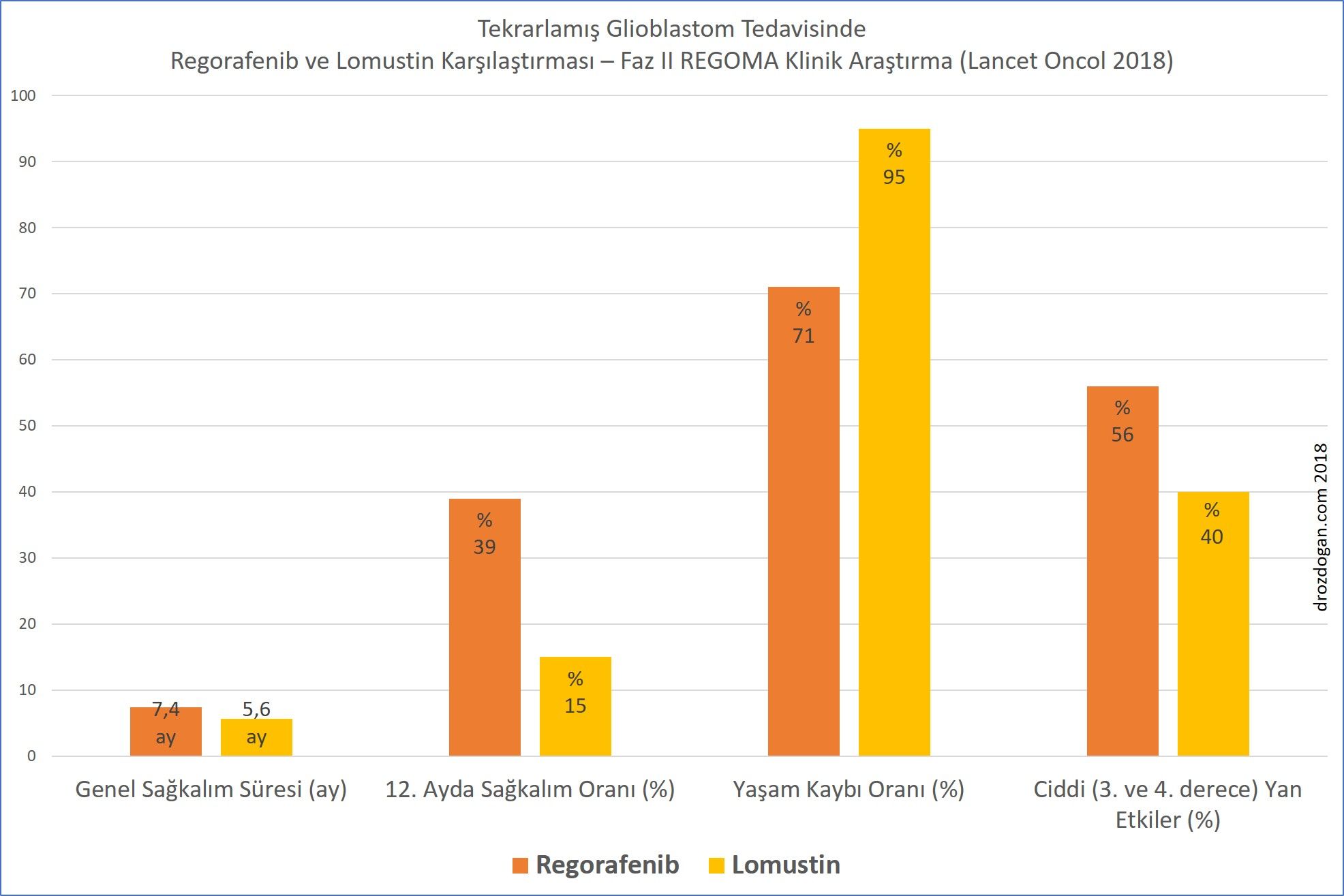
- Kasım 2015 ile Şubat 2017 tarihleri arasında 124 hasta tarandı ve 119 hasta rastgele seçim için uygun bulundu (59 hasta regorafenib, 60 hasta lomustin almaya atandı).
- Ortanca takip süresi 15.4 aydı.
- Analizin yapıldığı tarihte 119 hastanın 99'u (% 83) yaşamını kaybetmişti (regorafenib grubunun % 71'i, lomustin grubunun % 95'i).
- Regorafenib grubunda genel sağkalım 7.4 ay iken, lomusitn grubunda bu süre 5.6 ay bulundu.
- Regorafenib kullanımının, lomustin kullanımına göre yaşam kaybı riskini % 50 azalttığı bulundu.
- 12. ayda, regorafenib alan hastaların % 38.9'una karşılık lomustin alanların % 15'i hayatta idi.
- Ciddi (grad 3-4) yan etkiler, regorafenib ile tedavi edilen 59 hastanın 33'ünde (% 56) ve lomustin alan 60 hastanın 24'ünde (% 40) meydana geldi.
- Regorafenib ile ilgili en sık görülen ciddi (3 veya 4 derece) yan etki, el-ayak cilt reaksiyonu, lipaz artışı ve kan bilirubin yükselişi idi. Lomustin grubunda en sık ciddi yan etki azalmış trombosit, lenfosit ve nötrofil sayıları idi. Tedavi ilaçları ilişkili bir yaşam kaybı görülmedi.
Sonuç
REGOMA çalışmasında, ağızdan hap şeklinde alınan bir kanser ilacı olan regorafenib, tekrarlamış glioblastoma multiforme için genel sağkalım avantajını göstermiştir. Bu ilaç, GBM'li hastalar için yeni bir potansiyel tedavi olabilir ve yeterince güçlü bir faz III çalışması ile de araştırılmalıdır.
Giuseppe Lombardi ve ark.
Regorafenib compared with lomustine in patients with relapsed glioblastoma (REGOMA): a multicentre, open-label, randomised, controlled, phase 2 trial.
The LANCET Oncology, 03 December 2018.