HPV (insan papilloma virüsü) için TEDAVİ EDİCİ aşılar
HPV olarak kısaltılan "insan papilloma virüsü" birçok kanser türünden sorumludur. Bu kanser türlerine başta servikal (rahim ağzı) kanserler olmak üzere anal kanserler ve baş-boyun kanserleri örnek olarak verilebilir. Önceki yazılarımızda HPV etkeninin ne olduğuna, nasıl bulaştığına ve hangi mekanizmaları kullanarak bağışıklık sistemimizden gizlendiğine değinmiştik. Bu yazımızda ise HPV tedavisinde kullanılan terapötik (tedavi edici) aşıları ele alacağız.
Not: Genel olarak 2 türlü aşı bulunmaktadır: Koruyucu ve tedavi edici aşılar. Aşı söz konusu olduğunda hepimizin aklına koruyucu aşılar gelir (çocukluk çağı aşıları, koronavirüs aşıları ve Gardasil gibi HPV aşıları). Terapötik (tedavi edici) aşılar ise yeni bir kavramdır; örneğin melanom için Lmlygic ve prostat kanseri için Provenge.
Tedavi edici HPV aşısı nedir?
Terapötik HPV aşıları, HPV ile enfekte olmuş hücrelere karşı hücre aracılı bağışıklık geliştirerek öncül lezyonları ve malign (kanserli) tümörleri yok etmeyi amaçlamaktadır. Bu nedenle aşılar HPV antijenlerini hedeflemektedir. Aşı yaklaşımları çeşitlilik göstermektedir:
- Canlı-vektör bazlı aşılar,
- Peptit-protein bazlı aşılar,
- Nükleik asit bazlı aşılar ve
- Hücre-bazlı aşılar.
Antijen nedir?
Antijen, vücuda girdiğinde veya vücutta başkalaşıma uğradığında (örneğin kanser hücreleri) bağışıklık sistemi tarafından yabancı olarak algılanarak antikor oluşmasına yol açan protein yapısındaki maddeleridir. Antijenler, çoğunlukla virüs, bakteri ve parazit gibi mikroorganizmaların kendilerine özgü parçalarıdır.
Aşıların etki mekanizmalarını anlamak için HPV’nin biyolojik yapısı
- HPV zarfsız bir virüstür ve çift zincirli, halkasal DNA molekülüne sahiptir.
- Papillomaviridae ailesinin bir üyesi olan HPV, 6 adet erken protein (E1, E2, E4, E5, E6, E7) ve 2 adet geç protein (L1, L2) kodlamaktadır.
- Erken proteinler virüs DNA’sının çoğalmasını kolaylaştırır ve hücresel proteinleri üretir; geç proteinler ise yeni virüsleri çevrelemek üzere viral kapsid yapısını oluştururlar.
- Bu proteinleri kodlayan genlerden olan E6 ve E7 virüs ile enfekte olan hücrelerde daha çok eksprese (ifade) edilir. Bunun sonucunda E6 ve E7 proteinleri artar.
- E6, p53 proteinini; E7 ise RB genini baskılayarak normal olan hücre döngüsünü bozarlar ve enfekte edilen hücrelerin kanserli hücreye dönüşümünü sağlarlar.
- E2 geni de E6 ve E7 üzerinde baskılayıcı bir etkiye sahiptir ve yine enfekte hücrelerde E2 azalarak E6 ve E7 protein sentezi arttırılır.
- İşte aşılar da bu genler üzerine çeşitli şekillerde etki ederek HPV tedavisini sağlamaya çalışmaktadır.
Terapötik HPV aşı çeşitleri
1. Canlı-vektör bazlı aşılar
Taşıyıcı olarak virüs ve bakterilerin kullanıldığı aşılardır. Vektör bazlı aşıların temeli dendritik hücrelere antijen sunumuna dayanır. Canlı-vektör kullanılan birçok aşı, konak hücrede hemen çoğalarak antijenlerin hücreler arasında yayılmasını sağladığı için oldukça immünojeniktir. Ancak toksisite yapabilme riski gibi kullanımını sınırlayan bazı faktörler de vardır. Canlı vektör kullanılan aşıları 2 sınıfta inceleyebiliriz:
- Bakteriyel vektörler
- Viral vektörler
Bakteriyel vektörler
Dendritik hücrelere antjen sunumunda zayıflatılmış bakteriler kullanılabilir. L.monocytogenes, Salmonella, Lactococcus lactis kullanılan bakterilere örnek olarak verilebilir. Bakteriyel vektör kullanılan aşılarda; E7 spesifik T hücre aracılı bağışıklık cevabının güçlü bir şekilde ortaya çıktığı gösterilmiştir.
Viral vektörler
Viral vektörler de oldukça immünojeniktir. Aşılarda vaccinia virus, adenovirüs ve adeno-ilişkili virüs gibi çeşitli türler kullanılbilir (koronavirüse karşı geliştirilen Oxford-AstraZeneca aşısı da viral vektör olarak adenovirüs kullanmaktadır).
Bu virüsler arasında vaccinia virüsün antijen spesifik immünoterapi vaadettiği ve enfeksiyonlara karşı daha etkili olduğu düşünülmektedir. MVA-E2 adı verilen rekombinant vaccinia virüsü E2 proteinini sentezleyebilir. Bu vektörün kullanıldığı aşı CIN (servikal intraepitelyal neoplazi) ve kondiloma lezyonlarına sahip olan hastalatda test edilmiştir. Yapılan çalışmalar sonucunda hastaların MVA-E2 aşısına karşı antikor geliştirdiği ve kanserleşen hücrelerde spesifik T lenfosit yanıtının oluştuğu gösterilmiştir.
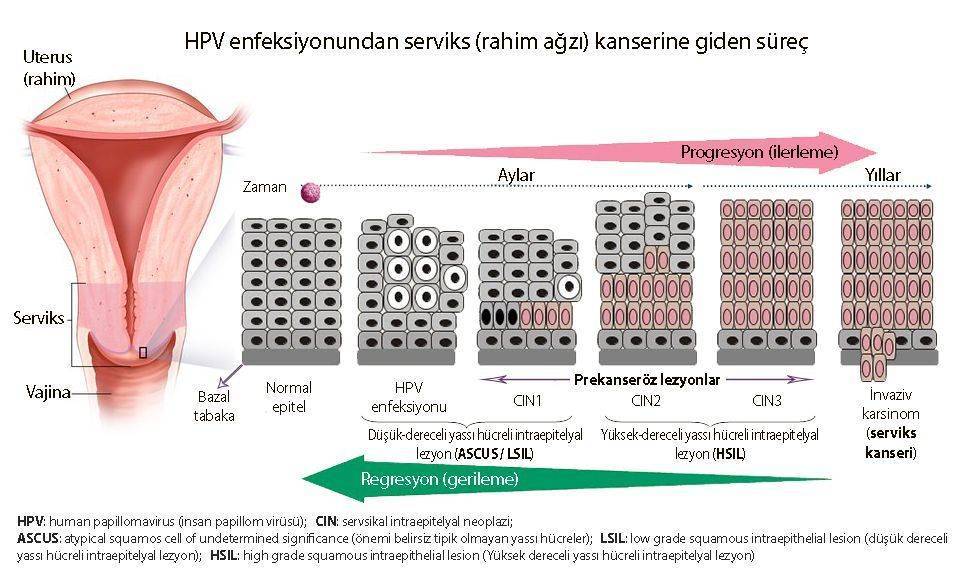
Aşağıda, HPV enfeksiyonunda kansere gidiş süreci resmedilmiştir:
2. Peptit / Protein bazlı aşılar
Peptid bazlı aşılar
HPV antijenleri kullanılarak elde edilen peptitler de HPV’ye karşı aşılamada kullanılabilir. Mekanizması ise şöyledir: HPV’nin antijenik proteinleri vücüt içine alındığında dendritik hücreler tarafından tutulur ve HLA molekülü (insan lökosit antijeni) üzerindeki MHC-1 veya MHC-2 ile ilişkili yolaklar ile sunularak bağışıklık yanıtı oluşturulur. Bu aşılar genel olarak güvenlidir ve üretimleri de kolaydır fakat yine de kullanımları kısıtlıdır. Bunun nedeni bu aşıların MHC'ye özgü olmasıdır ve birçok farklı HLA tipi olduğunu düşünürsek her hastada etkili olan bir aşı geliştirmek de zordur, ayrıca bu aşılar düşük düzeyde bağışıklık sağlamaktadır. Birçok çalışmada; aşının bu tip özellikleri nedeniyle potansiyelini arttırmak adına kemokinler ve sitokinler gibi destekleyici moleküllere odaklanılmaktadır.
Bu tip aşıların çalışmalarına örnek verelim: Lipitlenmiş HPV-E7 peptit bazlı aşının denendiği Faz 1/2 insan çalışmasında aşılanan 18 hastadan 3’ünde displazinin yok olduğu, 6’sında ise lezyonlarının belirgin şekilde gerilediği gösterilmiştir.
Protein bazlı aşılar
Peptit bazlı aşılarda olduğu gibi protein bazlı aşılar da güvenlidir ve kolayca üretilebilirler; dahası peptit bazlı aşılardan farklı olarak MHC spesifik değillerdir. Protein yapıdaki antijenler; dendritik hücreler tarafından işlenebilir ve yüzeylerinde sunulabilir ek olarak olası her HLA epitopunu içerirler. Fakat buna rağmen düşük bir immünojenik aktiviteye sahiptirler sonuç olarak potansiyellerini arttırmak için destekleyici moleküller kullanılmaktadır. Başka bir sınırlandırıcı özelliği de: aşı uygulandıktan sonraki süreçte antijen sunan hücrelerin (APC), MHC 1 sunumu için enjekte edilen proteinlerle bazen karşılaşarak onları yutması ve etkisizleştirmesidir. Protein bazlı aşılar üzerine yapılan çalışmalara örnekler:
- HPV-16 L2, E6 ve E7 füzyonundan oluşan TA-CIN aşısı uygulandığı tüm kadınlarda antikor üretimini sağlamıştır ve güvenli olduğu kanıtlanmıştır.
- Bir başka çalışma HPV-16 E7 ile M.bovis hsp16 proteininin birleşiminden oluşan aşı çalışmasıdır. Bu çalışmada aşının; yüksek dereceli anal intraepitelyal neoplazisi (AIN) olan hastaların tümünde iyi tolere edildiği gösterilmiştir.
3. Nükleik asit bazlı aşılar
Nükleik asit bazlı aşılar 2 çeşittir:
- DNA molekülü kullanılan aşılar ve
- RNA replikon kullanılan aşılar.
Bu aşı tiplerinden detaylı olarak bahsedeceğiz.
DNA bazlı Aşılar
DNA aşıları; antijen spesifik immünoterapi stratejisinde potansiyel olarak etkilidirler. Çıplak (yani hücre ve proteinlerle beraber olmayan) DNA güvenli, stabil ve üretimi kolaydır.
DNA aşıları diğer aşılarla kıyaslandığında:
- RNA aşıları veya protein aşılarına göre daha uzun süreli antijen ekspresyonu sağlar.
- Canlı-vektör kullanılan aşılara kıyasla; nötralizan antikor üretiminine neden olmaz ve böylece aynı hastaya tekrar tekrar aşı uygulanabilir.
DNA aşıları diğer aşılara göre daha güvenli olmasına rağmen aşıyla ilgili bazı endişeler de bulunmaktadır. Örneğin; DNA, konakçı genomuna entegre olarak o hücrenin genomunu bozabilir fakat buna ilişkin herhangi bir veri yoktur. Bir diğer endişe de immünojenik aktivitesinin zayıf olmasıdır bunun sebebi aşıdaki DNA’nın HPV ile enfekte hücrelerden çevredeki hücrelere geçiş ve çoğalış özelliğine sahip olmamasıdır. İşte bu gibi nedenlerden dolayı DNA aşısının etkinliğini arttırmak adına birtakım stratejiler geliştirilmiştir.
İlk strateji antijen eksprese eden dendritik hücrelerin arttırılmasıdır. Bu amaca ulaşmak için kullanılan bir yöntem “gen tabancası” yöntemidir ve oldukça da potenttir. “Gen tabancası”; DNA kaplı altın pariküllerini fırlatır ve bu sayede olgunlaşarak T hücresine dönüşmek üzere lenfoid organlara göç eden dendritik hücreler transfekte olur (transfeksiyon: bir hücrenin içine dışarıdan bir DNA parçasının girmesi anlamına gelir). Bunun sonucunda da çıplak DNA molekülü dendritik hücrelerin yapısına girer. Dendritik hücreleri arttırmada kullanılan bir diğer yöntem de “Dendritik hücreler arasında kodlanmış antijenin yayılmasını sağlamaktır.” Bunun için antijeni hücreler arası taşıma yapabilen bir proteine bağlamak gerekmektedir.
Diğer bir strateji de dendritik hücrelerde antijen ekspresyonunu, işlenmesini ve sunumunu arttırmaktır. "Kodon optimizasyonu" adı verilen bir teknik sayesinde bu stratejiyi uygulamak mümkündür. Bu teknik ile nadir kullanılan kodonlar yaygın kullanılanlar ile yer değiştirilir böylece antijen gen dizilimi değiştirilir ve dendritik hücrelerde DNA aşısının translasyonunu arttırır. (Translasyon: mRNA'nın kontrolü altında meydana gelen polipeptid sentezidir. ) Antijenin; proteozom yıkımını hedef alan veya endoplazmik retikulumu hedefleyen bir proteine bağlanması da MHC-1 antijen sunumunun artması yoluyla sitotoksik T-lenfosit (CTL) yanıtının arttırılmasını sağlar. Örneğin; MHC-1 antijen sunumunu arttıran bir protein olan Kalretikülin’e (CRT) bağlı E7 içeren bir aşının E-7 spesifik CD8 T-hücre cevabını arttırdığı ve E7-ekspre eden tümörlere karşı etkili olduğu gösterilmiştir.
Diğer bir teknik ise "MHC-1 tek zincirli trimer (SCT) tekniğinin kullanılmasıdır." Bu teknik; antijen işlenmesini engeller ve DNA aşısının kodladığı peptidin MHC-1 sunumunu sağlar.
DNA aşısının etkinliğini arttırmada kullanılan son strateji ise dendritik hücre ve T-hücre arasındaki etkileşimi arttırmaktır. Bir antijen işlendikten ve sunulduktan sonra dendritik hücreler ve T-hücreler arasındaki etkileşim T-hücre aktivasyonu açısından oldukça önemlidir. Hazırlık evresinden (priming) sonra dendritik hücreler, aktive olmuş efektör T hücreler için hedef haline gelir. Dendritik hücrelerde gerçekleşen bu T hücre aracılı apoptozisi önlemek için DNA; dendritik hücre yaşamını uzatan antiapoptotik proteinler kodlayabilir. Fareler üzerinde yapılan bir çalışmada E7 kodlayan DNA ve Bcl-2 gibi antiapoptotik protein kodlayan DNA’nın birlikte verildiği aşının; E7 spesifik T hücre yanıtını arttırdığı gösterilmiştir. Ayrıca DNA aşıları dendritik hücrelerin yaşam sürelerinin uzatarak antijen sunumunu da arttırmaktadır.
RNA replikon aşıları
Replikasyonun gerçekleştiği genom birimine replikon denir. RNA replikonları ise transfekte olan hücrelerde çoğalabilen çıplak RNA molekülüdür. RNA replikonlar alfa-virüsler veya Semliki forest virüslerinden elde edilebilirler. RNA replikon bazlı vektörler kanser aşılarının geliştirilmesi için birçok avantaja sahiptir. Örneğin bu replikonlar çok çeşitli hücrelerde replike olabilmektedir ve hücrelerde sürekli bir antijen sunumu olması için kullanılabilir. Bu nedenle geleneksel DNA aşılarına göre daha immünojenik olduklarını söyleyebiliriz. Birçok replikon viral gen içermemektedir, böylece herhangi bir enfeksiyöz partikül üretilmez ve replikon vektörüne karşı immün yanıt sınırlanır. Bu özellikleri nedeniyle RNA replikon aşıları aynı kişilerde tekrar kullanılabilir. Ayrıca replikon aşıları DNA aşıları ile ilişkili kromozomal integrasyon riskini de azaltırlar. Ancak replikon aşıları DNA aşılarına kıyasla daha az stabildirler. RNA replikon molekülünün ve DNA aşılarının avantajlarının kombinasyonu ile oluşturulan bir alternatif olan DNA-launched RNA replikon ortaya çıkmıştır. Bu moleküle “suisidal DNA” adı verilmiştir. HPV aşısının geliştirilmesinde preklinik çalımalarda suicidal DNA kullanılmıştır. Transfekte olan hücrede suicidal DNA; RNA’ya dönüşmüş ve etkili bir şekilde tümör antijeni eksprese edilmesini sağlamıştır.
Replikonlarda kullanılan bir strateji de “Kunjin (KUN)” yöntemidir. Burada replikonları dağıtmak için bir flavivirus olan Kunjin kullanılır. HPV-16 E7 eksprese eden KUN replikonları ile aşılanan farelerde yapılan çalışma sonucunda spesifik T-hücre yanıtının uyarıldığı ve farelerin tümöral değişime karşı korunduğu gösterilmiştir. Sonuç olarak RNA replikon molekülünün birçok avantajı olsa da RNA-replikon bazlı aşıların klinik çalışmaları ve eldeki veriler sınırlıdır bu nedenle daha çok çalışmanın incelenmesine ihtiyaç vardır.
4. Tam hücre temelli aşılar
Dendritik hücre bazlı aşılar
HPV’ye karşı geliştirilen aşılarda dendritik hücrelerin kulanılması da bir başka mantıklı stratejidir. Bu tip bir aşı oluşturabilmek için dendritik hücrelerin viral antijen ile yüklenmesi gereklidir. dendritik hücreler; MHC-1 ve 2 moleküllerinin fiziksel olarak aktarımıyla ex-vivo (canlı dışında) olarak hazırlanabilir. Dendritik hücrelere antijen yüklemesi ise; peptit veya protein yapılı antijenler yoluyla ya da HPV antijeni kodlayan DNA / RNA molekülünün aktarımıyla gerçekleştirilebilir. Etkili aşılar otolog dendritik hücreler kullanılarak geliştirilmiş olsa da tabii ki bireyselleştirilmiş aşıların üretilmesi zordur. Ayrıca dendritik hücrelerin hazırlanmasında kullanılan kültür tekniği de aşının kalitesini etkileyen bir faktördür.
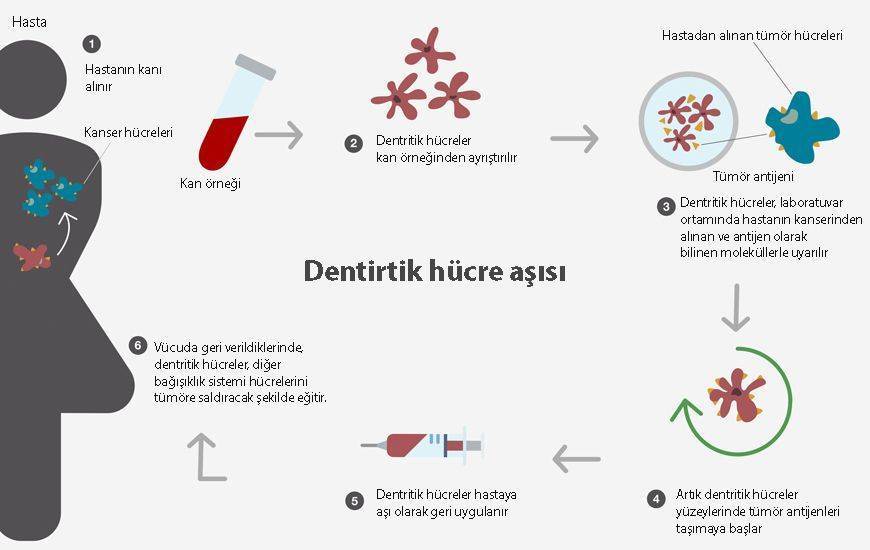
Dendritik hücre bazlı aşıların etkinliği arttırmak amacıyla birkaç yöntem öne sürülmüştür. Bunlardan biri önceki başlıklarda da bahsettiğimiz Dendritik hücrelerin yaşam sürelerini arttırmaktır. Örneğin bir çalışmada; Bak ve Bax gibi proapoptotik proteinleri hedefleyen küçük interfere RNA (siRNA) ile enfekte olan E7 yüklü dendritik hücreler test edilmiştir. Çalışma sonucunda; dendritik hücrelerde bulunan Bak ve Bax proteinlerinin baskılandığı ve bu sayede T-hücre aracılı apoptoza karşı dürencin arttığı gösterilmiştir.
Dendritik hücre bazlı aşılarının klinik denemeleri devam etmektedir. Bir klinik çalışmada metastatik rahim ağzı kanseri hastası olan kişiye HPV-18 E7 ile yüklü dendritik hücreler subkutan olarak enjekte edilmiştir. Sonrasında hastada tümör ilerleyişinin baskılandığı gösterilmiştir. Ayrıca tam remisyon (gerileme) olmamasına rağmen kişinin sağlık durumunun iyileştiği ve de herhangi bir yan etkinin gözlemlenmediği bildirilmiştir.
Tümör-hücresi bazlı aşılar
Tam hücre temelli aşıların geliştirilmesinde kullanılan 2. yaklaşım ise tümör hücrelerinin kullanılmasıdır. Tümör hücrelerinin immünojenik etkilerini arttırmak için Ex-vivo (canlı dışında) olarak uyarılarak sitokinler gibi çeşitli immünmodülator proteinleri üretmeleri sağlanabilir. Bu aşılarda IL-2, IL-12 ve GM-CSF gibi sitokin genleri kullanılmaktadır. Avantajlarından biri tümör antijenlerinin net olarak tanımlanamamasıdır ve kolaylıkla üretilebilmeleridir.
Tümör hücresi bazlı aşılar preklinik modellerde test edilmektedir. Örneğin; farelerde yapılan GM-CSF üreten E7 pozitif tümör hücresinin kullanıldığı aşılamada, aşının E7 spesifik T-hücre yanıtına öncülük ettiği ve antitümöral etkinliği arttırdığı gösterilmiştir.
Fakat bu tip aşıların yeni kanserler geliştirme riskleri de bulunmaktadır. Bu sebeple tümör-hücresi bazlı aşıların geliştirilmesi sınırlıdır.
1. Chien-Fu, H., Ma, B., Monie, A., Tsen, S.-W. & Wu, T.-C. Trials and Future Directions. Expert Opin Biol Ther. 8, 421–439 (2008).
2. Andrew Yang, Jessica Jeang, Kevin Cheng et al. Current state in the development of candidate therapeutic HPV vaccines. Expert Rev Vaccines 2016 Aug
3. Gemma Hancock, Karin Hellner, Lucy Dorrell. Therapeutic HPV vaccines. Best Practice & Research Clinical Obstetrics & Gynaecology 2018 Feb
4. Zahra Yazdani, Alireza Rafiei, Reza Valadan, Hossein Ashrafi, Marzieh Sharifi Pasandi, Mostafa Kardan. Designing a potent L1 protein-based HPV peptide vaccine: A bioinformatics approach. Comput Biol Chem 2020 Apr