
Ribosiklib (Valamor) Nedir? FDA Onayı, Türkiye Ruhsatı ve Geri Ödeme Durumu
- İlk FDA Onayı: 2017
- Kutu Adı: Valamor (Türkiye), Kisqali (ABD)
- Etken Madde Adı: Ribosiklib
- Uygulama Şekli: Ağız yoluyla alınır (oral).
- Sınıfı: Sinyal transdüksiyon inhibitörü, CDK (Cyclin-dependent kinase) inhibitörü.
- Kategori: Hedefe yönelik ajan (Targeted agent).
- Üretici: Novartis
- Türkiye Dağıtımı: Novartis
- Onaylı Olduğu Kanserler: Ribosiklib, özellikle hormon reseptörü (HR) pozitif, HER2-negatif yüksek riskli erken evre ve metastatik meme kanseri tedavisinde FDA tarafından onaylanmıştır.
Valamor Nedir? Ne İşe Yarar ve Nasıl Etki Eder?
Valamor (etken maddesi ribosiklib), hormon reseptörü pozitif meme kanseri olan hastaları tedavi etmek için klasik hormon baskılayıcı ilaçlar ile birlikte kullanılabilen yeni nesil kanser ilaçlarından biridir. Valamor, küçük moleküllü bir sikline bağımlı kinaz (CDK) inhibitörüdür. İlaç, hücrede sikline bağımlı kinaz (CDK) 4 ve CDK 6 adı verilen proteinleri bloke eder.
Hormon pozitif meme kanseri hücrelerinde, bu proteinlerin bloke edilmesi, hücrelerin yeni hücreler oluşturmak için bölünmesini durdurmaya yardımcı olur. Bölünme sürecinde hücrelerin G1'den S hücre döngüsü aşamasına geçmesini önlemeye yardımcı olur. Bu, kanser büyümesini yavaşlatır. Valamor ve bir aromataz inhibitörünün (örneğin letrozol, anastrazol) veya seçici östrojen downregülatörünün (fulvestrant) kombinasyonu, tek başına kullanıma göre daha etkilidir.
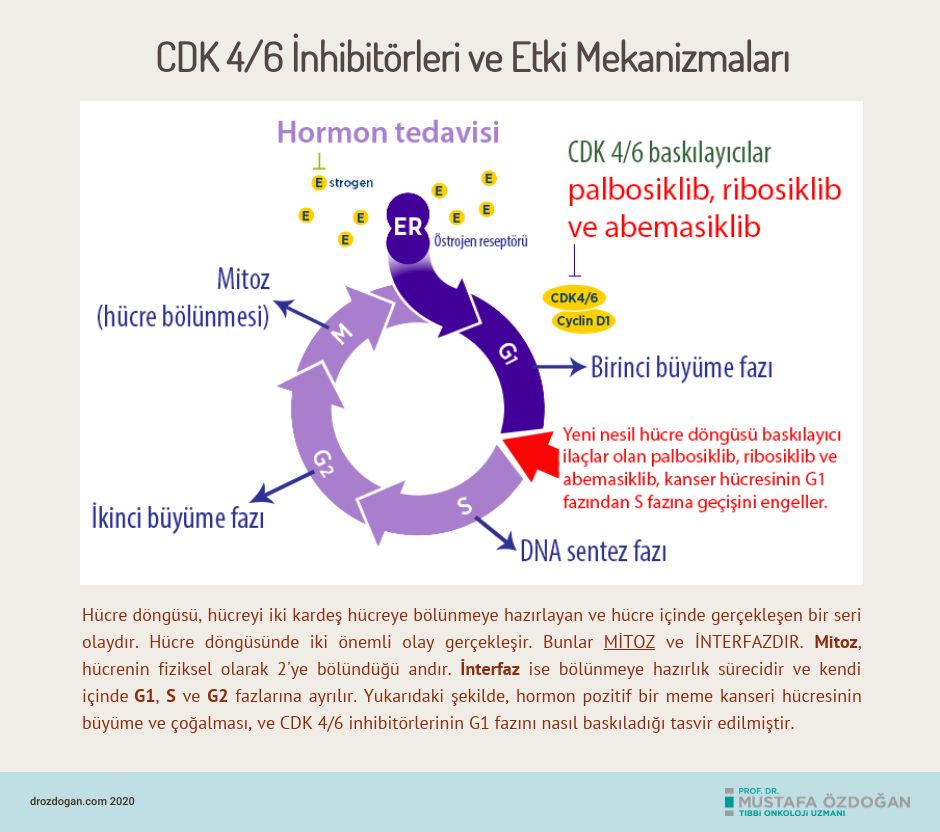
Hedefe yönelik akıllı kanser tedavileri, kanser hücreleri ile normal hücreler arasındaki farkları anlamaya adanmış yaklaşık 100 yıllık araştırmanın sonucudur. Bugüne kadar kanser tedavisi, öncelikle hızla bölünen hücreleri öldürmeye odaklanmıştı. Çünkü kanser hücrelerinin bir özelliği, hızlı bölünmeleridir. Ne yazık ki, bazı normal hücrelerimiz de hızla bölünmektedir, bu yüzden kemoterapilere bağlı birden çok yan etki oluşmaktadır.
Hedefe yönelik tedavi, kanser hücrelerinin diğer özelliklerini tanımlamakla ilgilidir. Bilim insanları, kanser hücrelerinde ve normal hücrelerde belirli farklılıklar ararlar. Bu bilgi, normal hücrelere zarar vermeden kanser hücrelerine saldırmak için hedefli bir tedavi oluşturmak için kullanılır. Böylece daha az yan etkiye yol açar. Her bir hedefe yönelik tedavi türü biraz farklı çalışır, ancak hepsi kanser hücresinin büyüme, bölünme, onarım ve / veya diğer hücrelerle iletişim kurma becerisine müdahale eder.
FDA (ABD Gıda ve İlaç İdaresi) Onay Tarihçesi:
Ribosiklib etken maddeli Valamor'un FDA onay tarihleri ve endikasyonları (hangi durumlarda kullanılabileceği) aşağıdaki gibidir:
- Mart 2017: İleri evre hormon pozitif HER2 negatif postmenopozal meme kanserli kadınlarda, aromataz inhibitörü (Aİ) ile birlikte 1. basamakta onay aldı.
- Temmuz 2018: İleri evre hormon pozitif HER2 negatif hem premenopozal hem perimenopozal hem de postmenopozal ileri evre hastalarda Aİ ile birlikte 1. basamakta onay aldı. Ayrıca postmenopozal hastalarda fulvestrant ile birlikte 1. veya 2. basamakta onay aldı.
- Eylül 2024: Hormon reseptörü (HR) pozitif, insan epidermal büyüme faktörü reseptörü 2 (HER2) negatif, nüks riski yüksek evre 2 ve 3 meme kanserinin adjuvan tedavisi için ribosiklibin aromataz inhibitörü ile birlikte kullanımını onayladı.
Türkiye Ruhsatı:
Ribosiklib etken maddeli Valamor, T.C. Sağlık Bakanlığı tarafından şu endikasyonlar için ruhsatlandırılmıştır.
-
VALAMOR, NSAİ (nonsteroidal aromataz inhibitörü) ile kombine kullanımı halinde östrojen reseptörü (ER) en az %10 pozitif, insan epidermal büyüme faktörü 2 (HER2) negatif pre/peri/postmenopozal metastatik meme kanseri olan, daha önce metastatik hastalık için endokrin tedavi almış hastalar ile birlikte adjuvan NSAİ tedavisinin tamamlanmasından 12 ay sonra relaps yapmış veya adjuvan tamoksifen tedavisi sırasında veya sonrasında relaps yapmış hastalarda endikedir.
-
VALAMOR, östrojen reseptörü (ER) en az %10 pozitif ve HER2 (-) olan pre/peri/postmenopozal metastatik meme kanserli, daha önce fulvestrant kullanmamış hastalarda:
- Metastatik hastalık tedavisi için ilk sıra ve en az 6 ay aromataz inhibitörü alırken klinik veya radyolojik hastalık progresyonu görülenlerde fulvestrant ile birlikte kullanılır.
- Adjuvan aromataz inhibitörü tedavisini 12 ay ve süreyle kullandıktan sonra ya da adjuvan aromataz inhibitörü tedavisini tamamladıktan sonraki 12 ay içinde nüks/metastaz yapmış hastalarda fulvestrant ile birlikte kullanılır.
- Daha önce fulvestrant kullanmış metastatik hastalarda metastatik hastalık tedavisinin ilk sırasında NSAİ kullanımı önerilir. Bu hastalarda daha sonra endokrin tedavisi almamış olan hastalarda kullanılamaz.
-
Pre/perimenopozal kadınlarda endokrin tedavisi, luteinizan edici hormon salgılatıcı hormon (LHRH) agonisti ile birleştirilmeldir.
Geri Ödemesi Var mı?
Valamor'un Sosyal Güvenlik Kurumu (SGK) tarafından geri ödeme kapsamına alındığı tedavi durumları şu şekildedir:
Östrojen Reseptörü en az %10 pozitif ve İnsan Epidermal Büyüme Faktörü Reseptörü 2 (HER-2) negatif, postmenopozal nüks/metastatik meme kanseri olan hastalarda aşağıda yer alan kriterler çerçevesinde bedelleri Kurumca karşılanır:
-
Nüks/metastatik meme kanseri için daha önce hiç endokrin tedavi almamış veya adjuvan tedavinin tamamlanmasından 12 ay sonra nüks/metastaz gelişmiş hastalarda:
- Letrozol ile kombine olarak kullanılması halinde bedelleri Kurumca karşılanır.
-
Nüks/metastatik meme kanseri tedavisi için birinci sıra aromataz inhibitörü tedavisini 6 aydan daha uzun süre kullandıktan sonra klinik ve/veya radyolojik hastalık progresyonu varlığında:
- Fulvestrant ile kombine olarak kullanılması halinde bedelleri Kurumca karşılanır.
- Daha önce fulvestrant tedavisi almış veya adjuvan aromataz inhibitörü tedavisinin ilk 12 ayı içinde relaps yapan veya metastatik hastalık için bir sıradan daha fazla aromataz inhibitörü almış hastalarda kullanılması halinde bedelleri Kurumca karşılanmaz.
-
Adjuvan aromataz inhibitörü tedavisi devam ederken (en az 12 ay almış olmak şartıyla) ya da bu tedavi tamamlandıktan sonraki 12 ay içinde nüks/metastaz görülen hastalarda:
- Fulvestrant ile kombine olarak kullanılması halinde bedelleri Kurumca karşılanır.
- Daha önce fulvestrant tedavisi almış veya adjuvan aromataz inhibitörü tedavisinin ilk 12 ayı içinde relaps yapan veya metastatik hastalık için bir sıradan daha fazla aromataz inhibitörü almış hastalarda kullanılması halinde bedelleri Kurumca karşılanmaz.
Direnç Mekanizması:
Ribosiklibe karşı gelişen direnç, CDK6'nın aşırı ekspresyonu veya CDK2'nin artmış ifadesi ile oluşabilir. Ayrıca, pRb proteininin kaybı, cyclin A ve E'nin aşırı üretimi de ilaca karşı direnç oluşturabilir.
Emilim:
Ribosiklibin oral biyoyararlanımı yaklaşık %46’dır. İlacın doruk plazma düzeyleri genellikle 1-4 saat içinde ulaşılır. Gıdanın emilim üzerinde belirgin bir etkisi yoktur.
Dağılım:
Ribosiklib, plazma proteinlerine yaklaşık %70 oranında bağlanır. Kararlı durum plazma seviyeleri yaklaşık 8 gün içinde elde edilir.
Metabolizma:
Karaciğerde geniş ölçüde metabolize edilir ve esas olarak CYP3A4 mikrozomal enzimleri tarafından metabolize edilir. İlacın yaklaşık %70’i feçes yoluyla, %23’ü idrarla atılır.
Doz Aralığı:
Valamor başlangıç dozu; aralıksız 21 gün boyunca günlük 600 mg (3 tane 200 mg tablet) kullanılır, 7 gün ilaç kullanmaya ara verilir. Bu şekilde 21 gün ilaç kullanıp 7 gün ara verilmesine 1 kür denilir.
Valamor genelde hastalar tarafından evde kullanılır.
Tedavi, artık işe yaramayana veya kabul edilemez yan etkiler yaşanana kadar sürdürülür. Her kür 28 günde bir tekrarlanır.
İlaç Etkileşimleri:
- İlaç Etkileşimi 1: CYP3A4 enzimlerini uyaran ilaçlar (fenitoin, karbamazepin, rifampin vb.) Ribociclib’in plazma düzeylerini düşürebilir.
- İlaç Etkileşimi 2: CYP3A4 inhibitörleri (ketokonazol, itrakonazol vb.) Ribociclib’in plazma düzeylerini artırarak toksisite riskini yükseltebilir.
- İlaç Etkileşimi 3: QT uzamasına neden olan ilaçlarla kombinasyondan kaçınılmalıdır.
Dikkat Edilmesi Gereken Durumlar:
- Valamor yiyecekle birlikte veya aç karnına alınabilir. Tableti bütün olarak yutun ve çiğnemeyin, ezmeyin veya kırmayın.
- Bir dozu atlarsanız, dozu telafi etmeyin, sonraki dozu planlandığı gibi ertesi gün alın.
- Oda sıcaklığında orijinal ambalajında saklayın. Kullanana kadar tabletleri blister ambalajlardan çıkarmayın.
- Bazı yan etkiler yaşanırsa doz ayarlamaları gerekebilir. Yaşadığınız yan etkiler konusunda onkologunuzu bilgilendirin.
- Bazı antifungal, antibiyotik ve nöbet ilaçlarıyla etkileşime girebilir. Olası etkileşimler için doktorunuzdan veya eczacınızdan ilaçlarınızı gözden geçirmesini isteyin.
- Nar, greyfurt, yıldız meyvesi, kan portakalı ve bu meyvelerin suları ile etkileşime girebilir ve Valamor’un kan seviyelerinde artışa neden olabilir. Bu, yan etkilere maruz kalma riskinizi artırabilir. Tedavi sırasında nar, greyfurt, yıldız meyvesi, kan portakalı yemekten veya bu meyvelerin sularını içmekten kaçının (bakınız kanser tedavisi sırasında greyfurt ve nar gibi gıdalardan neden kaçınmalı?). Limon, misket limonu ve diğer portakallar ve bunların suları tüketilebilir.
- Sarı kantaron kullanmaktan kaçının çünkü Valamor’un kan seviyelerini düşürecektir. Bu, tedavinin etkinliğini azaltabilir.
- Kalp ritmini bozduğu bilinen ilaçlarla etkileşime girebilir. Eczacınızdan bu tür etkileşimli ilaçlardan herhangi birini alıp almadığınızı iki kez kontrol etmesini isteyin.
- Hamileyken alındığında venine zarar verebilir. Çocuk doğurma çağındaki kadınlar Valamor alırken ve son dozdan sonra en az 3 hafta boyunca etkili doğum kontrolü kullanmalıdır. Tedavi sırasında veya son dozdan en az 3 hafta sonra emzirmeyin.
Yan Etkiler:
En sık olandan en seyrek olana göre yan etkiler şunlardır:
Valamor kullanan hastalarda aşağıdaki yan etkiler yaygındır (% 30'dan fazla görülür):
- Düşük kan sayımı; beyaz ve kırmızı kan hücreleriniz ve trombositleriniz geçici olarak azalabilir. Bu sizi enfeksiyon, anemi ve / veya kanama için artan riske sokabilir.
- Mide bulantısı ve kusma
- Karaciğer enzimlerinde (ALT ve AST) artış
- Yorgunluk
- İshal
- Saç kaybı
Valamor kullanan hastalarda aşağıdaki yan etkiler daha az yaygındır (% 10-29 oranında görülür):
- Kabızlık
- Baş ağrısı
- Sırt ağrısı
- Böbrek fonksiyonunda azalma (kreatinin değerinde yükselme)
- İştah kaybı
- Döküntü
- Ateş
- Kaşıntı
- Ellerde ve ayaklarda şişlik (Ödem)
- Uykusuzluk
- Ağız yaraları
- İdrar yolu enfeksiyonu
Önemli: Valamor’un nadir fakat ciddi bir yan etkisi QT uzamasıdır. Anormal kalp atışları geliştirirseniz, baygınlık hissederseniz veya nefes darlığınız varsa, acil yardım almalı ve sağlık uzmanınıza bildirmelisiniz.
Hastaların yaklaşık yüzde 10'undan daha azında görülen çok nadir etkiler burada listelenmemiştir. Ancak herhangi bir olağandışı durum ile karşılaşırsanız her zaman sağlık uzmanınızı bilgilendirmelisiniz.
Ortalama olarak, hastaların % 8'i kabul edilemez yan etkiler nedeniyle tedaviyi bırakmaktadır. Hastanın % 33 kadarı, yan etkiler nedeniyle Valamor’un dozunun azaltılmasına ihtiyaç duyarlar.
Takip
Ne sıklıkla takip gereklidir?
Kan testleri genellikle her tedaviden önce kontrol edilir. Daha sonra ilk 2 kür için 2 haftada bir, daha sonra her kürün başında başlangıcında kan testleri kontrol edilir. Gerekli olan kan tahlilleri tam kan sayımı (hemogram), kapsamlı metabolik paneldir (biyokimya). Hekimin önerisine göre başka kan tahlilleri eklenebilir.
Görüntüleme ( radyolojik inceleme ) ne kadar sıklıkla gereklidir?
Bilgisayarlı tomografi (BT) taraması ve/veya manyetik rezonans görüntüleme (MRG), PET-BT (Pozitron Emisyon Tomografisi) gibi görüntüleme yöntemleri, tedaviden önce kontrol edilir. Daha sonra hekiminizin önerisine göre belirli periyotlarda tekrarlanabilir. Elektrokardiyogramlar (EKG) tedaviye başlamadan önce, tedaviye başladıktan yaklaşık 2 hafta sonra, 2. kürden önce ve daha sonra doktorunuzun takdirine bağlı olarak tekrarlanır. Kemik mineral yoğunluğunuzu (kemik gücü) izlemek için DEXA (çift enerjili x-ışını absorpsiyometrisi) taramaları yapılabilir.
Kan testi veya görüntüleme sonuçları tedaviyi nasıl etkiler?
Sonuçlara bağlı olarak doktorunuz Valamor kullanımına planladığı gibi devam edebilir, dozunu değiştirebilir veya tedaviyi değiştirebilir.
1. Slamon DJ, Neven P, Chia S, et al. Phase III Randomized Study of Ribociclib and Fulvestrant in Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: MONALEESA-3. J Clin Oncol. 2018
2. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib as First-Line Therapy for HR-Positive, Advanced Breast Cancer. N Engl J Med. 2016






