Hassas Onkoloji ve Bireyselleştirilmiş Tedavi – Geleceğin Tıbbına Kapsamlı Bir Bakış
Tıpta yeni bir dönemin başladığını temsil eden Hassas Tıp, genetik bilgimizin, tedavi yöntemlerimizi nasıl dönüştürdüğünün mükemmel bir örneğidir. İnsan Genom Projesi’nin 2003'te tamamlanmasıyla başlayan bu dönem, tedavilerimizi kişiselleştiren ve bilim insanlarının hastalıkları farklı bir pencereden görmelerini sağlayan hassas tıbbın temellerini atmıştır. Fakat bu süreçte, tıbbın nasıl bir evrim geçirdiğini ve hassas tıbbın ne olduğunu, ilkelerini, araçlarını ve uygulamalarını anlamak esastır.
Hassas Tıp: Geleceğin Tıbbına Dair Bir Perspektif
İnsanların genetik yapılarındaki ve çevresel faktörlerdeki bireysel farklılıkları dikkate alan Hassas Tıp, kişiye özel tedavi yöntemlerini bizlere sunar. Kanıta dayalı tıp ve geleneksel tıp uygulamalarından farklı olarak, hassas tıp; genetik, çevresel ve yaşam tarzı faktörlerini gözeterek bireysel tedavi yöntemleri geliştirmeyi amaçlar. Özellikle belirli hastalıklara yatkınlık veya belirli tedavilere yanıt konusundaki genetik farklılıklar, bu alandaki bilimsel çalışmaların odağı haline gelmiştir.
2015 yılında Amerika'da başlatılan Hassas Tıp İnisiyatifi (The Precision Medicine Inıtiative), bu alandaki bilinirliği ve popülerliği artırmış ve "hassas tıp" terimi, global olarak artan bir ilgi görmüştür. Arama motorlarında bile, "kişiselleştirilmiş tıp" terimini geçerek, tıp ve sağlık alanında bir trend haline gelmiştir.
Ancak, hassas tıbbın anlaşılması için tıp konseptlerinin evrimine, geleneksel tıptan kanıta dayalı tıbba, ve nihayetinde hassas tıbba uzanan bu yolculuğa bir göz atmamız gerekir. Her bir konseptin, tıp bilimi ve uygulamaları üzerindeki etkilerini inceleyerek, hassas tıbbın bizlere neler sunduğunu ve gelecekteki potansiyelini daha net bir şekilde görebiliriz.
Hassas tıbbın sağlığımız üzerindeki etkilerini tam anlamıyla kavrayabilmek ve bu alandaki geleceğimizi şekillendirebilmek için, bu bilim dalının hedeflerini, başarılarını ve potansiyel zorluklarını anlamamız kritik öneme sahiptir. İki ana hedef üzerine kurulu olan hassas tıbbın, hastalıkların çeşitli alt tiplerini sınıflandırma ve her hastalık alt tipi için hedefe yönelik tedaviler sunma konusunda nasıl bir yol izlediği, bu derlemede ele alınan ana konular arasındadır.
Hassas Tıbbın Doğuşu
Hassas tıp kavramı yeni olmasına karşın, konsept Hipokrat zamanlarına kadar dayanmaktadır. Kanadalı bir araştırmacı olan Dr. L.Y. Wei tarafından 1979'da "3P" (koruyucu tıp, hassas tıp ve halk tıbbı) kavramı ortaya atılmıştır.
Genom tabanlı hassas tıp, İnsan Genom Projesi’nin tamamlanmasından sonra ortaya çıkmış ve hastalıkların genetik temeline dair bilgiler, kişiye özel tedavilere yönlendirmeye başlamıştır.

- Tabakalaştırılmış (stratified) Tıp: Hastaları risk veya tedavi yanıtına göre gruplandırmayı ve böylece tedavilerden maksimum faydayı sağlamayı amaçlar. Hastalık ve tanı konusundaki bilgilerimizi kullanarak, klinik karar verme süreçlerini daha kesin hale getirebiliriz.
- Kişiselleştirilmiş (personalized) Tıp: Terim ilk kez 1971'de kullanılmış olup, genetik profil bilgisinin kullanılmasıyla hastalıkların önlenmesi, teşhisi ve tedavisi konusundaki kararlar yönlendirilmeye başlanmıştır. "Kişiselleştirilmiş tıp" terimi, kamuoyunda kafa karışıklığına neden olmuş, 2013 yılındaki bir ankette terimi sadece %4’lük bir kesimin anladığı belirlenmiştir.
- Bireyselleştirilmiş (individualized) Tıp: Topol, "kişiselleştirilmiş tıp" terimini "bireyselleştirilmiş tıp" ile değiştirme teklifinde bulunmuştur. Bu terim, daha önce bireyin hastalığını, özel olarak hazırlanmış bir terapiyle eşleştirmek anlamında kullanılmıştır. Onkofaj gibi spesifik hastalara yönelik aşılar ve kök hücre bazlı terapiler buna örnektir.
- P4 Tıbbı: 2004 yılında Hood tarafından ortaya atılan P4 tıbbı; öngörülebilir (predictive), önleyici (preventive), kişiselleştirilmiş (personalized), ve katılımcı (participatory) tıp anlamına gelmektedir. Geniş bir bilgi ağı kullanarak, halk sağlığına yönelik kapsamlı tıbbi yaklaşımları mümkün kılmayı ve toplumun sağlık durumunu izlemeyi hedefler.
Hassas tıp, genel olarak, hastalık tedavi ve önleme yaklaşımlarını daha kişiselleştirilmiş ve etkili bir yöntemle ele almayı amaçlar. Bu farklı terimler ve konseptler, genetik ve biyolojik verilere dayanarak hastalıkları daha etkili ve bireysel bir şekilde anlamamıza ve tedavi etmemize yardımcı olmayı hedefler. Hastaların ortak bir biyolojik hastalık temeli üzerinden alt gruplara etkili bir şekilde sınıflandırılmasını savunur.
Hassas tıbın uygulanması için iki ana hedef bulunmaktadır:
- Hastalıkları çeşitli alt tiplere doğru olarak sınıflandırmak
- Bu spesifik alt tipler için hedeflenmiş tedavileri bulmak
Çeşitli omik bilimlerde, elektronik sağlık kayıtlarında ve büyük veri analizlerindeki ilerlemeler sayesinde, bu iki hedef giderek daha erişilebilir hale gelmiştir.
"Omik" terimi, biyolojik sistemlerin geniş çaplı ve bütünsel analizlerini ifade eder. Biyolojik ve biyomedikal bilimlerde, "omik" terimi genellikle genetik, transkriptomik, proteomik, metabolomik gibi spesifik alanlara atıfta bulunmak için kullanılır. Bu terimler sırasıyla genlerin, RNA moleküllerinin, proteinlerin ve metabolitlerin bütünsel ve sistemik analizini ifade eder. Omik analizler, genellikle yüksek verimli teknolojiler ve büyük veri analitiği kullanılarak, biyolojik sistemlerin ve hastalıkların daha iyi anlaşılması amacıyla gerçekleştirilir.
Hassas Tıp için Doğruluk ve Kesinlik Kavramları
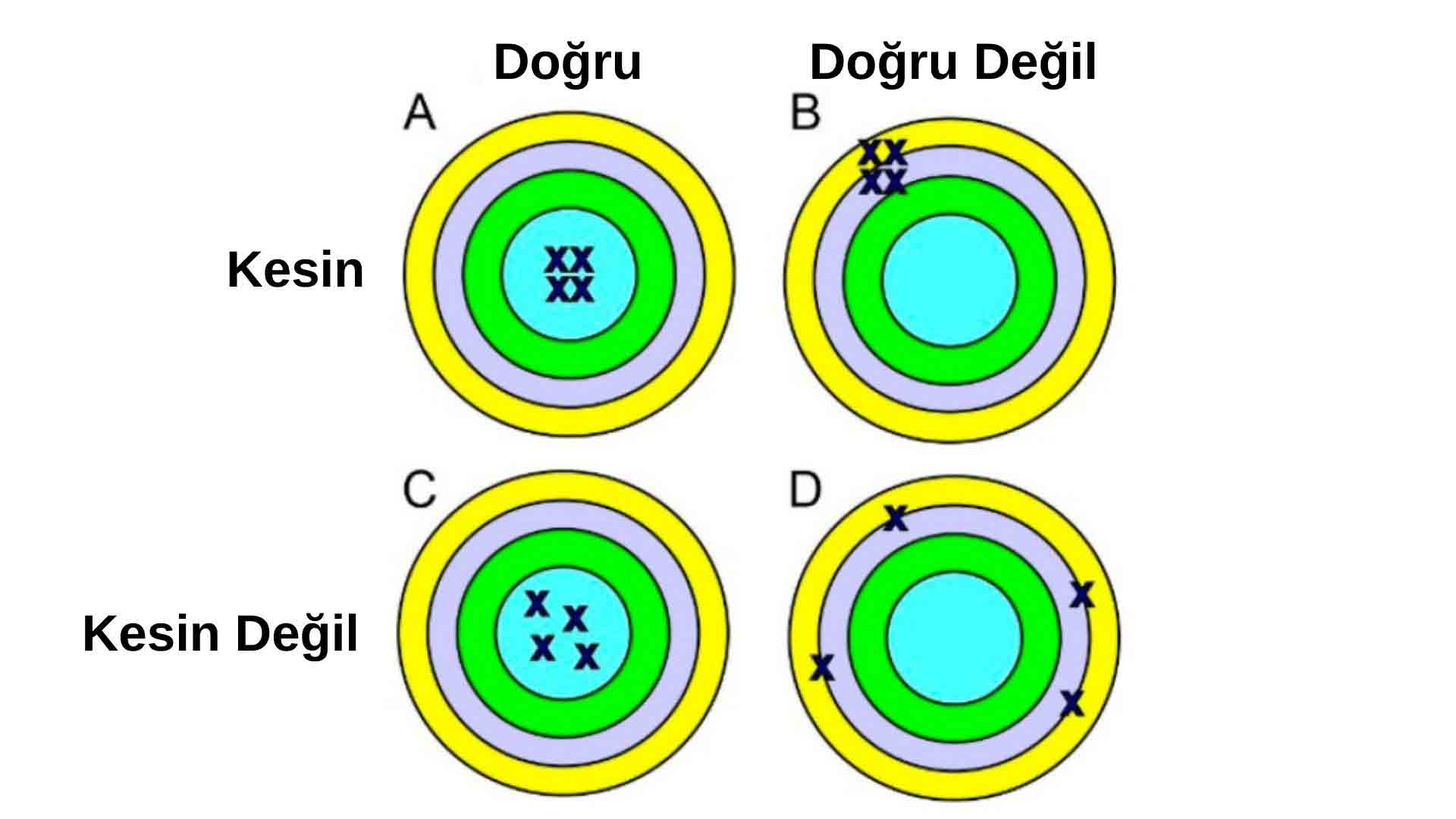
Hassas tıp, "doğruluk" ve "kesinlik" kavramlarını içerir;
- Doğruluk, bir ölçümün standart veya doğru değere ne kadar uyduğunu,
- Kesinlik ise tekrarlanan ölçümlerin birbirine olan yakınlığını ifade eder.
Hassas tıp pratiğinde, genomların doğru bir şekilde temsil edilmesi (doğruluk) ve genetik testlerin tekrarlanabilir (kesin) olması kritik öneme sahiptir, zira eksik veya hatalı genetik testler bireyler ve aileler için ciddi sonuçlar doğurabilir.
Hastalıkları Alt Gruplara Ayırma
Hassas tıp, belirli bir hastalığı, hastanın spesifik özelliklerine dayanarak belirgin alt gruplara sınıflandırma amacı taşır, bu da tedavi kararlarını belirli bir alt gruba göre yönlendirir. Bu kavram, kanser, otizm, astım, otoimmün ve kardiyovasküler hastalıklar gibi çeşitli rahatsızlıklar için alt tiplendirme yapmaya yönelik kapsamlı araştırmalar yapılmasını sağlamıştır. Bilimsel ve tıbbi açıdan, hastalık alt tiplendirme, tedavi kararlarını ve beklenen maliyetleri daha bilinçli bir şekilde yönetmeye yardımcı olabilir, aynı zamanda genetik test tasarımı ve hastalıkların nedenlerini daha iyi anlamak için bilimsel araştırmalara rehberlik edebilir. Hastalık mekanizmasıyla doğrudan ilişkilendirildiğinde bu alt tiplere "endotip", tedavi amaçları için benzer hastaları temsil ettiğinde ise “verotip” adı verilir.

Hastalık alt tiplendirme, geçmişte doktorların farklı hastaların belirtilerini ve tedavi yanıtlarını gözlemleyerek ve ardından bu gözlemleri doğrulamak için araştırma yaparak yürüttüğü bir süreçti. 20 yıldır, modern yüksek verimli biyoteknolojiler ve "-omik" verilerin (genomik, proteomik, vb.) maliyetlerindeki düşüş, bilim insanlarını alt tiplendirme için hesaplamalı yaklaşımlara yönlendirmiştir. Bu hesaplamalı yaklaşımlar; moleküler alt tiplendirme için çeşitli biyobelirteçler ve - omik veriler, elektronik sağlık kayıtları ve derin fenotipleme temelli klinik alt tiplendirme gibi yöntemleri içerir ve çevresel, sosyal ve davranışsal faktörleri de dikkate alır. Bu entegratif yaklaşım, hastaların daha kapsamlı bir şekilde değerlendirilmesine ve daha kişiye özel tedavi stratejilerinin belirlenmesine olanak tanır.

Moleküler Alt Tiplendirme: -Omics (Omikler)
Çok faktörlü ve yaşamı tehdit eden hastalıklar, özellikle kanser, kardiyovasküler hastalıklar ve diyabet, kompleks ve heterojen yapılarıyla hassas tıbbın uygulama alanıdır. Geleneksel biyobelirteç belirleme yöntemleri bu tür hastalıkların moleküler alt tiplendirilmesi için yetersiz kalmakta. Bu nedenle "Omics" (omik) teknolojileri bu boşluğu doldurmaktadır. İnsan Genom Projesi ile başlatılan ve "Omics" olarak adlandırılan bu teknolojiler, yüksek verimli ve detaylı biyolojik analizler sağlayarak, genomik, epigenomik, transkriptomik, proteomik, metabolomik, mikrobiyomik ve metagenomik gibi alt dallara ayrılır. Yeni nesil dizileme (NGS) teknolojisi, omiklerin alt dallarında geniş kapsamlı ve detaylı moleküler veri üretme kapasitesi ile öne çıkmaktadır. Bu teknoloji, bireylerin geniş kapsamlı moleküler profillemesini sağlayarak hastalıkların alt tiplerinin daha detaylı anlaşılmasına ve bu hastalıklar için daha özelleştirilmiş tedavi stratejilerinin geliştirilmesine imkan tanır.
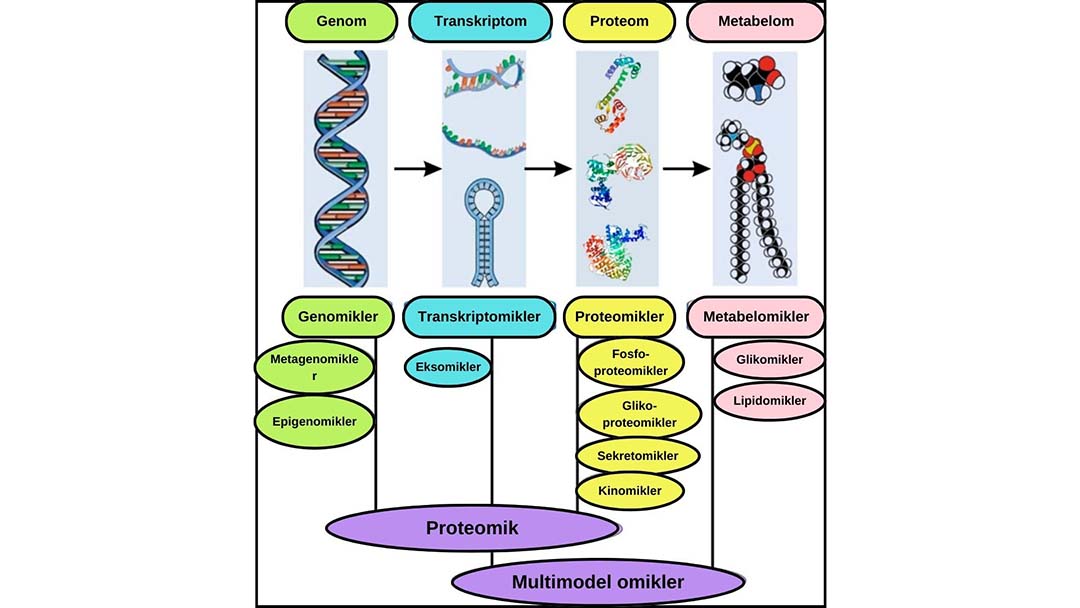
Genomik
Genomik, bir "omics" alt dalı olarak, bütün genomların incelenmesini merkezine alır ve genetikten farklı olarak, sadece tek genler yerine tüm genomu ele alır. Mendeliyen (tek gen hastalıkları) ve kompleks hastalıkların genetik varyantlarını incelemekte kullanılan genomik yaklaşımlar arasında genom çapında ilişkilendirme çalışmaları (GWASs), tüm genom dizileme (WGS) ve tüm ekzom dizileme (WES) bulunmaktadır.
- GWASs, genetik varyantlar (değişimler, mutasyonlar) ve kompleks hastalıklar arasındaki ilişkileri anlamada kullanılır.
- WGS ve WES, genin farklı bölümlerinin sıralanmasında kullanılır.
Bu teknolojiler, özellikle yeni nesil dizileme (NGS) teknolojisine dayanarak, geniş kapsamlı veri üretme kapasitesi sunar. WGS ve WES'in her biri, farklı avantajlar ve sınırlamalar sunar: WES, daha hızlı ve derin kapsam sağlarken, WGS daha geniş bilgi sağlar ve düzenleyici bölgelere dair bilgiler içerir. Ayrıca, tek hücreli genomik dizileme (SGS), bireysel hücrelerin genomunu analiz ederek, tümör ve tümör olmayan hücreler arasındaki genomik varyasyonları detaylıca inceleme olanağı sunar.
Epigenomik
Epigenomik, gen ekspresyonundaki (ifadesindeki) değişikliklere odaklanır ve bu değişiklikler, genetik yapıda bir değişiklik olmaksızın gerçekleşir. Temelde, bu alandaki çalışmalar, DNA metilasyonu, histon asetilasyonu ve mikroRNA (miRNA) gibi epigenetik modifikasyonların nasıl ve neden gerçekleştiğini, ayrıca bu değişikliklerin organizma üzerindeki etkilerini inceler. DNA ve histonların kimyasal modifikasyonları, gen transkripsiyonunu düzenlerken, miRNA'lar gen ekspresyonunu yönetir ve düzenler.
Epigenetik modifikasyonlar, genetik ve çevresel faktörler tarafından yönlendirilir ve bu modifikasyonlar bazen kalıtsaldır ve hastalık durumlarında, özellikle kanser, kardiyovasküler hastalık ve metabolik sendrom gibi durumlarında, önemli rol oynarlar.
Epigenomik çalışmalar, bu epigenetik değişiklikleri anlamak, epigenetik biyobelirteçleri tanımlamak ve epigenetik hedefli terapötik stratejiler geliştirmek için kullanılan teknikler üzerinde yoğunlaşır.
DNA'nın bisülfat ile işlenmesi, DNA metilasyonunu değerlendirmek için ilk adım olarak kullanılırken, kromatin immünopresipitasyonu (ChIP) ve sonraki dizileme (ChIP-seq) genişliğinde histon modifikasyonlarını inceleme aracı olarak kullanılır. miRNA ekspresyonunu değerlendirmek için kullanılan teknikler arasında mikroarrayler, qRT-PCR ve küçük RNA-seq bulunur.
Epigenomik, sadece hastalığın anlaşılmasına yardımcı olmakla kalmaz, aynı zamanda hastalığın teşhisi, prognozu ve tedavisi için potansiyel stratejiler geliştirebilir.
Transkriptomik
Transkriptomik, bir hücre veya belirli bir durumdaki tüm RNA transkriptlerini inceleyen bir bilim dalıdır. 1990'ların başlarında geliştirilen bu alanda, ilk yıllarda gen ekspresyon analizi için mikroarrayler yaygın olarak kullanılmıştır. Ancak günümüzde, NGS (Yeni Nesil Dizileme) teknolojisinin gelişmesi ve maliyetin azalmasıyla birlikte RNA-seq, transkriptom analizi için tercih edilen yöntem haline gelmiştir.
Transkriptomik, bir organizmanın biyolojisini, gen ekspresyonundaki farklılıkları ve belirlenmemiş gen işlevlerini anlamamıza yardımcı olur, bu da insan hastalıklarını daha iyi anlamamızda önemli bir rol oynar. Transkriptomik, tek bir zaman noktasında transkriptomun bir "anlık görüntüsünü" sağlar ve bu nedenle, ölçümler farklı zamanlarda ve koşullarda değişiklik gösterir. Mekansal transkriptomik, gen ekspresyonunu mekansal olarak yerelleştirebilir ve hücreler arasındaki ekspresyon farklılıklarını ve hastalık nedenselliğini anlamamıza yardımcı olabilir.
Proteomik
Proteomik, proteinlerin kompozisyonu, işlevi, etkileşimleri ve yapılarını inceleyen bir bilim dalıdır. Proteomlar, gen ifadesinin ve post-translasyonal modifikasyonların bir yansıması olarak, hücre işlevlerini gerçekleştiren ana moleküllerdir. Proteomik genellikle MS (Kütle Spektrometresi) tabanlı yüksek verimli yöntemlerle gerçekleştirilir.
Proteomik’in başlıca üç türü vardır:
- Ekspresyon proteomik: Protein ekspresyonundaki farkları belirlemeye yöneliktir.
- Yapısal proteomik: Proteinlerin üç boyutlu yapısını ortaya çıkarmaktadır.
- İşlevsel proteomik: Protein işlevlerini ve etkileşimlerini ortaya çıkarmaktadır.
Proteomik, gen ekspresyon seviyelerinin, protein seviyelerini sadece kısmen temsil ettiği ve post-translasyonal modifikasyonların (örneğin, fosforilasyon ve ubiquitinasyon) protein işlevini önemli ölçüde değiştirebileceği bir disiplindir. Bu özellik, genlerin anlaşılmasına ve özellikle hastalıkla ilişkili protein ve sinyalizasyon yollarının keşfinde kritik bir öneme sahiptir.
Metabolomik
Metabolomik, geniş bir ölçekte metabolitlerin yani hücreler, dokular ve organizmalar içindeki küçük moleküllerin incelenmesiyle ilgilenir. Bu, metabolom olarak bilinen metabolitlerin toplamını ve bu metabolitlerin biyolojik bir sistem içerisindeki etkileşimlerini kapsar.
Metabolomik çalışmaları, ultra performanslı sıvı kromatografisi (UPLC), nükleer manyetik rezonans (NMR) ve kütle spektrometrisi (MS) gibi analitik platformları kullanarak, biyolojik sistemlerde aminoasitler, lipidler ve karbonhidratlar gibi çeşitli metabolit türlerini nicelendirir.
Metabolomik, birçok insan hastalığıyla, özellikle kardiyovasküler hastalık, diyabet ve kanserle, ilişkilendirilen metabolik anormallikleri inceleyebilir. Aynı zamanda, bu alandaki analitik teknolojilerin gelişmesiyle birlikte, metabolomik patolojik mekanizmaları aydınlatmak, yeni ilaç hedefleri bulmak, ilaç etkileşimlerini yorumlamak, ilaç yanıtlarını tahmin etmek, tanısal biyobelirteçler saptamak (erken tanı) ve hastalar için kişiselleştirilmiş tedavi yaklaşımlarını optimize etmek gibi çeşitli uygulamalarda güçlü bir araç haline gelmiştir.
Metabolit seviyeleri ve oranları, genelde metabolik işlevin güvenilir göstergeleridir ve anormallikler genellikle hastalık durumunu gösterir. Metabolomik, metabolit seviyelerinin nicel ölçümleri ile, çeşitli dokularda ve vücut sıvılarında küçük molekül metabolizmasını düzenleyen genetik bölgeleri tanımlama kapasitesine sahiptir.
Mikrobiyomik ve Metagenomik
Mikrobiyom, insan vücudunu kolonize eden tüm mikroorganizmaları, yani bakterileri, virüsleri ve mantarları, kapsayan bir terimdir. Mikrobiyomik, bu mikroorganizmaların ve ilişkili moleküllerin yapısını, işlevini ve dinamiklerini inceleyen bilim dalıdır. İnsan vücudunun çeşitli kısımları (bağırsaklar, cilt ve mukozal yüzeyler) mikroorganizmalar tarafından kolonize edilir ve bu mikroorganizma topluluğu mikrobiota olarak adlandırılır. Metagenomik ise, bu mikroorganizmaların geniş genetik potansiyelini anlamamıza olanak tanıyan, mikrobiyal genlerin genişletilmiş genetik analizini içerir.
İnsan mikrobiyomunun analizi, metagenomik ve diğer "omics" analizleri kapsar. Mikrobiyom, insan vücudunun birçok bileşeni üzerinde ve ayrıca hastalık gelişimi ve genel sağlık durumu üzerinde önemli bir etkiye sahiptir. Özellikle, mikrobiyom, bağırsak-beyin ekseni ve bağışıklık sistemi ile etkileşimler yoluyla insan sağlığı üzerinde etkilidir ve ilaç metabolizması üzerinde de önemli bir rol oynayabilir. Mikrobiyomun işleyişinin anlaşılması, hastalık mekanizmalarını ve tedavi seçeneklerini daha iyi anlamamıza yardımcı olabilir.
Klinik Olarak Zenginleştirilmiş Alt Tipler ve Derin Fenotiplendirme
Fenotip, bir bireyin gözlemlenebilir biyolojik özelliklerini ifade ederken, fenotipleme bu özelliklerin analizi ve tanımlanmasıyla ilgilidir. Derin fenotipleme, bu özelliklerin detaylı ve kapsamlı bir analizini sağlar.
Hassas tıp, hastaları fenotip ve genotip gibi özelliklere dayanarak alt gruplara ayırma hedefler. Fenotip ve genotip verilerinin entegrasyonu, bu alt grupların belirlenmesi ve tedavi stratejilerinin geliştirilmesinde kritiktir.
Elektronik sağlık kayıtları gibi veri kaynakları ve algoritmalar, bireyleri fenotipik özelliklerine göre alt tiplere ayırmada kullanılır. Farklı alt tipler, hastalığın seyri, tedavi yanıtı ve komplikasyonlar açısından farklılıklar gösterebilir.
Fenotip tanımlamalarının yetersizliği ve dağınıklığı, özellikle nadir hastalıklarda ve eksik veri setlerinde analizleri güçleştirebilir. Hassas tıp yaklaşımlarıyla, hastalık alt tiplerine özelleştirilmiş tedaviler, farmako-omik yaklaşımlar ve işlevsel hassas tıp yaklaşımları geliştirilebilir.
Özellikle belirlenen moleküler alt tipleri hedef alacak tedavilerin geliştirilmesi, farmako-omikler ve işlevsel hassas tıp yaklaşımları hassas tıp uygulamalarında önemli rol oynamaktadır.
Hedefe Yönelik Tedavilerin Gelişimi ve Uygulamaları
Hedefe yönelik tedaviler, spesifik patojenik moleküller veya hücrelere odaklanan terapötik ilaçları içerir, böylece sadece hastalığa neden olan hücresel süreçleri hedef alır ve normal hücrelere zarar riski azalır. Bu kavram, Paul Ehrlich tarafından "sihirli mermiler" (magic bullets) anlayışı ile başlatılmış ve bu yaklaşım, bir ilacın spesifik olarak hastalığı hedef almasını ve böylece daha kesin ve kişiselleştirilmiş bir tedavi sağlamasını amaçlar. İnsan Genom Projesi ve omik teknolojilerdeki ilerlemeler sayesinde, hastalıkların ilerlemesindeki mekanizmalar daha kesin bir şekilde anlaşılmakta ve bu da hedefe yönelik yeni ilaçların tasarımını mümkün kılmaktadır. Hedefe yönelik tedaviler, özellikle onkoloji alanında, spesifik kanser tiplerini hedefleyen ilaçlar geliştiren güçlü bir alandır. Ayrıca kardiyovasküler hastalıklar, otoimmün hastalıklar ve kistik fibrozis gibi diğer durumlar için de uygulanmıştır.

Kanserde Moleküler Hedefe Yönelik Tedavi Stratejileri ve İlerlemeler
Kanser tedavisinde hedefe yönelik yaklaşımlar, kanser hücrelerinin ve tümörlerin belirli moleküler ve biyolojik mekanizmalarını spesifik olarak hedef almayı amaçlar. 1990'ların sonlarına dek, kanser tedavisinde kullanılan ilaçlar genellikle genel olarak hücre bölünmesini hedef alırken, bu ilaçlar aynı zamanda normal hücrelere de zarar veriyordu. 1980’lerde, bilim insanları kanser hücrelerinin spesifik büyüme faktörleri ve onkogen ürünleri üzerine odaklanmış ve bu bilgiyi kullanarak, trastuzumab (Herceptin), gefitinib (Iressa), imatinib (Gleevec) ve setuksimab (Erbitux) gibi kansere özgü sinyalleri bloke eden ilaçları geliştirmiştir.
Ayrıca, anjiyogenez inhibitörleri, tümörlerin yeni kan damarları oluşturmasını ve böylece büyümesini engeller. İlk bu tarz ilaç olan bevasizumab (Avastin, Altuzan) 2004 yılında onaylanmış ve bu alanda yeni ilaçlar geliştirilmeye devam etmektedir.
Son zamanlarda, kanseri tetikleyen moleküler mekanizmalar ve tetikleyiciler, ilaç geliştirme çalışmalarının merkezine yerleşmiş olup, antikorlar ve küçük moleküller olmak üzere iki ana stratejiyi içermektedir.
Antikorlar
Antikor tabanlı terapötikler, kanser tedavisinde önemli bir rol oynamaktadır ve monoklonal antikorlar (mAb'ler), bu alandaki ilk gelişmeler arasında yer alır. mAb'ler, genellikle yüksek bir spesifiteye sahiptir ancak uygulama metodları genellikle intravenöz veya subkütan enjeksiyon ile sınırlıdır, çünkü hedefleri çoğunlukla hücre yüzeyine özgüdür ve büyük moleküler yapıları vardır. İlk nesil mAb'ler fare kökenli olduğundan, insanlarda kullanıldığında bazı kısıtlamalar ve sorunlar ortaya çıkmış, ancak sonraki geliştirmelerle (örn. kimerik ve humanize mAb'ler) bu sorunlar aşılmıştır.
Humanize mAb'ler, fare değişken bölgelerinin tamamını veya bir kısmını muhafaza ederken, fare Fc domainini insan Fc domaini ile değiştirir, bu da insan vücudundaki bağışıklık tepkisini azaltır. İnsan IgG1 izotipi, Fc-domain tabanlı işlevleri, özellikle de antikor bağımlı hücresel sitotoksisiteyi (ADCC) aracılamasıyla önemlidir ve geniş bir şekilde kullanılmaktadır.
FDA tarafından onaylanan ilk iki mAb olan rituksimab ve trastuzumab, sırasıyla 1997 ve 1998 yılında piyasaya sürülmüştür ve 25 yıl içerisinde, 100'den fazla mAb onay almıştır.
Antikor terapileri üç farklı kategoriye ayrılır:
- Çıplak Antikorlar: Temelde doğal IgG (immunglobulin G) özelliklerini taşırlar. Trastuzumab gibi.
- Genetik Mühendisliği Teknikleri ile Geliştirilen Antikorları: Sitotoksik (hücre öldürücü) T hücrelerini hedef alırlar, bu hücrelerin hastalıkla savaşmasını potansiyelize ederler. İmmün kontrol noktası inhibitörleri ve CAR T-hücre terapisi gibi hücresel tedavilerde kullanılanlar.
- Antikor-İlaç Konjugatları: Sitotoksik yükleri, yani kemoterapi moleküllerini taşırlar ve bu yükleri hedef hücrelere ulaştırırlar, böylece hastalıklı hücreleri yok ederler. Örneğin trastuzumab deruxtecan.

Şekil Açıklaması: Antikor tabanlı kanser tedavileri, farklı etki mekanizmalarına dayanarak üç kategoriye ayrılabilir:
- IgG'nin doğal özelliklerine dayanan çıplak antikorlar, ADCC, ADCP, CDC ve hücresel sinyallemenin inhibisyonunu içerir
- Sitotoksik T hücrelerini devreye sokan mühendislikle geliştirilmiş antikorlar, bağışıklık kontrol noktası inhibitörlerini (ICIs), T-hücresini devreye sokan bispecific antikorları (T-biAb) ve tek zincirli değişken parçacık (scFv) kullanarak kimerik antijen reseptör T hücrelerini (CAR-Ts) içerir
- Sitotoksik yükleri ileten antikor konjugatları, antikor–ilaç konjugatlarını (ADCs), antikor-radionüklid konjugatlarını (ARCs) ve immunositokinleri içerir
Küçük Molekül İnhibitörler
Küçük molekül inhibitörler, kanser tedavisinde, özellikle klasik kemoterapiye direnç gösteren ileri evre kanser vakalarında önemli bir yere sahiptir.
FDA, bu bağlamda 43 farklı küçük molekül inhibitörünü onkoloji alanında kullanım için onaylamıştır.
Bu inhibitörler genel olarak iki kategoriye ayrılır:
- Seçici küçük molekül inhibitörler
- Çoklu kinaz inhibitörleri
Seçici inhibitörler, daha az hedefle etkileşim gösterir ve genellikle spesifik bir hücresel sinyalleme bileşenini inhibe ederken, çok kinaz inhibitörleri daha geniş bir kinaz yelpazesini hedef alır ve daha düşük bir spesifiteye sahiptir. Seçici inhibitörler, belirli biyomarkerlerin varlığına dayanarak hastalar için seçilirken, çok kinaz inhibitörlerinin kullanımı genellikle histolojik tanıya dayanır ve ek bir bireysel hasta seçimi gerektirmez.
Küçük molekül inhibitörler, kanserle mücadelede ve uzun süreli hasta hayatta kalma oranlarının artırılmasında etkili stratejiler sunar, yan etkileri azaltabilir ve birinci basamak terapi olarak sitotoksik kemoterapinin yerini alabilir. Bu, hedefe yönelik tedavi stratejilerinin, kişiselleştirilmiş ve hassas tedavi yaklaşımlarını destekleyerek, hastalar için daha olumlu sonuçlar ve minimal yan etkiler sağlama potansiyeli taşıdığını göstermektedir.
Farmako-Omik Yaklaşımlar ve İlaç Yanıtının Bireysel Varyasyonları Anlamak
Farmako-omik, "omik" bilim dallarını kullanarak ilaç yanıtlarındaki bireysel varyasyonları ve bu varyasyonların altında yatan moleküler mekanizmaları inceleyen bir araştırma alanıdır. İlaç yanıtlarını anlamak ve yönlendirmek adına genel bir çatı sağlar ve bu alandaki çeşitli dallar, farklı moleküler düzeylerdeki yanıtları ve mekanizmaları araştırır.
Farmakogenomik, farmako-omikin en erken ve en gelişmiş dalı olarak karşımıza çıkmakta olup, ilaç yanıtlarını genetik düzeyde anlamamıza olanak tanır. Diğer dallar, aralarında farmakotranskriptomik, farmakoepigenetik, farmakoproteomik, farmakometabolomik ve farmakomikrobiyomik olmak üzere, gen ifadesi, epigenetik modifikasyonlar, protein seviyeleri, metabolit profilleri ve mikrobiyomun ilaç yanıtına olan etkilerini inceleyerek bu bilim dalının kapsamını genişletir. Bu geniş kapsamlı yaklaşım, bireyler arası ilaç yanıtlarındaki farklılıkları derinlemesine anlamamıza ve kişiselleştirilmiş tedavi stratejilerinin oluşturulmasına katkı sağlar.
Farmakogenomik
Farmakogenomik, genetik varyasyonlar ile ilaç yanıtları arasındaki ilişkiyi, geniş bir genomik bağlamda incelerken, farmakogenetik bu ilişkiyi daha dar bir çerçevede ele alır. Bu iki yaklaşım da bireylerin genetik yapılarını dikkate alarak, kişiselleştirilmiş ilaç tedavisi stratejileri oluşturma amacını taşır.
Başlangıçta sadece tek gen varyasyonları üzerine odaklanan farmakogenetik, bilim ve teknolojideki ilerlemeler sayesinde tüm genomu kapsayan bir araştırma alanı olan farmakogenomiğe dönüşmüştür. Bu genişleyen perspektif, farmakokinetik ve farmakodinamik mekanizmalar üzerindeki genetik etkileri ve bu etkilerin popülasyonlar arası farklılıkları incelemeyi, ve bu bilgileri klinik ve ilaç geliştirme süreçlerine entegre etmeyi mümkün kılar.
İki önemli örnek olarak, izoniazid ve süksinilkolinin genetik varyasyonlarla ilişkili yanıtları ve warfarin tedavisine genetik yaklaşım, farmakogenomik uygulamaların ve poligenik modelin önemini vurgular.
Farmakogenomik yaklaşım, gelecekteki ilaç tedavilerinin daha bireysel ve etkili olmasına olanak tanıyarak, kişiselleştirilmiş tıp uygulamalarının önünü açar.
Farmakotranskriptomik
Farmakotranskriptomik, transkriptom varyasyonlarını ilaç tedavisi ve dozajını kişiselleştirmek amacıyla inceler. Henüz yeni bir alanda olan bu bilim dalı, ilaç etkinliğinin değerlendirilmesi ve hedef keşfi için faydalıdır.
Bu konuda yapılan bir araştırma, onaylı bir antikanser ilaç olan lapatinib ve bir geleneksel tıp ürünü olan berberin ile tedavi görmüş olan tedaviye dirençli üçlü negatif meme kanseri hücrelerinin ve ferroptozisi düzenleyen gen ağlarının farmakotranskriptomik profillemesini kapsamaktadır. Bu profillemesi, ilaç tedavisi altındaki genlerin aktivitesini detaylı bir şekilde inceleyerek, bu maddelerin hücreler ve ferroptozis süreci üzerindeki etkilerini daha iyi anlamamıza yardımcı olmayı amaçlar.
Farmakoepigenetik
Farmakoepigenetik, ilaç tepkilerindeki bireysel varyasyonları inceleyen, özellikle epigenetik modifikasyonlar ve bu modifikasyonların ilaç yanıtlarını nasıl etkilediği üzerine odaklanan bir alandır.
Araştırmalar, epigenetik değişikliklerin ilaç tedavisi ile ilişkili olduğunu ve bu değişikliklerin ilaç etkilerini modüle edebileceğini göstermektedir. Epigenetik tedavilerin bazıları, gen modülasyonunu içerir ve spesifik gen varyasyonlarının belirli ilaçlara olan tepkileri üzerinde etkili olabilir.
Farmakoproteomik
Farmakoproteomik, proteomikin bir dalı olarak, protein seviyesindeki varyasyonları ve bu varyasyonların ilaç yanıtlarıyla olan ilişkisini inceler. Genetik ve transkriptomik verilere ek olarak, farmakoproteomik, bireysel farklılıkları ve bu farklılıkların ilaçlarla nasıl etkileşime girdiğini daha detaylı bir şekilde ele alır.
Son araştırmalar, bu alandaki potansiyel moleküler hedeflerin ve ilaçların böbrek gibi organları nasıl etkileyebileceğini belirlemeye yöneliktir.
Farmakometabolomik
Farmakometabolomik, farmakoloji ve metabolik fenotipler arasındaki ilişkileri inceleyen bir bilim dalıdır. Bu alan, metabolomik yaklaşımları kullanarak ilaçların vücuttaki hareketini (farmakokinetik) ve etkilerini (farmakodinamik) anlamayı, ilaç yanıtlarıyla ilgili biomarkerlar bulmayı ve ilaç araştırmaları için yeni hedefler belirlemeyi amaçlar.
Farmakometabolomik, özellikle belirli ilaçların etkileşimleri ve metabolizması üzerine odaklanarak, spesifik hastalıkların tedavisi için yeni stratejiler ve hedefler oluşturmada kullanılır. Örnek olarak, prostat kanseri ve akut miyeloid lösemi tedavisi için yeni moleküler hedeflerin belirlendiği araştırmalar ve astımlı bireylerde inhale kortikosteroid yanıtının incelendiği çalışmalar bulunmaktadır.
Ayrıca, Raman spektroskopisi rehberliği ile gerçekleştirilen hücre düzeyinde farmakometabolomik, tek hücre düzeyinde metabolitlerin incelenmesini mümkün kılan yeni bir tekniktir.
Fonksiyonel / İşlevsel Hassas Tıp
Fonksiyonel Hassas Tıp (FHT), tıbbın hassas ve kişiye özel bir dalıdır ve bu yaklaşım, etkilenen bireylerden alınan dokuların doğrudan ilaç tepkilerini incelemeye odaklanır. FHT, omik tabanlı hassas tıp uygulamalarının karşılaştığı bazı meydan okumaları ve eksiklikleri giderme amacı taşır.
Genom bilgisi tek başına hastaların tedaviye nasıl tepki vereceklerini tam olarak tahmin edemediği için, FHT bu boşluğu doldurmayı amaçlar.
Dinamik ve işlevsel veri üretimi sayesinde, bir bireyin tedaviye yanıtını etkileyebilecek çeşitli faktörleri - tümör mikroçevresi, gen ifadesi ve protein modifikasyonları gibi - daha geniş bir çerçevede inceleyebilir ve anlayabiliriz.
FHT, aynı zamanda, hızla gelişen yeni teknolojiler ve artan sayıda kanser ilaçlarıyla birlikte, hastalardan türetilen modellerle kanserlerin heterojenliğini ve tedaviye yanıtını daha kapsamlı bir şekilde inceleme olanağı tanır. Bu alandaki model geliştirme ve doğrulama, kısa ve uzun vadeli uygulamalara odaklanmakta ve hasta türevli xenografts, organoidler ve mikroakışkan çip teknolojileri gibi ön klinik modelleri içermektedir.
FHT’nin potansiyeli, tıbbi yaklaşımları daha işlevsel ve etkili kılarak hastalar için kişiselleştirilmiş tedavi stratejileri geliştirmede önemli bir rol oynayabilir.
Hasta-Türevli Xenograft (PDX) Modelleri
PDX modelleri, direk insan tümörlerini fareler üzerinde kullanarak kanser araştırmalarında kritik bir rol oynar, bununla beraber tümör hücrelerinin doğal ortamlarını daha doğru bir şekilde taklit eder ve klinik ile laboratuvar araştırmaları arasında bir köprü oluşturur. Ayrıca, PDX'ler, klinik yanıt ile ilaç yanıtları arasında yüksek korelasyon gösterme avantajına sahiptir, bu da onları ilaç yanıtlarını tahmin etme ve hastalara daha etkili tedaviler sunma konusunda değerli kılar.
Hasta-Türevli Organoid (PDO) Modelleri
PDO (patient derived organoids) modelleri, hastadan alınan tümör hücrelerini laboratuvar koşullarında 3D kültürlerde büyüterek, ilaç tepkilerini ve yeni tedavi yöntemlerini değerlendirir. İlk olarak pankreas kanserinde kullanılmış olmalarına rağmen, PDO'lar artık geniş bir kanser yelpazesi üzerinde araştırma ve tedavi testlerinde kullanılmaktadır. Fenotip ve genotipin korunması, bu modelin, ilaç keşifleri ve tedavi stratejileri açısından oldukça faydalı olmasını sağlar.

Şekil Açıklaması: Hastadan türetilmiş organoidler (PDO’ler) için bireyselleştirilmiş tümör tepki testi.
Hastanın tümöründen doku, tanısal biyopsi yoluyla elde edilir ve daha sonra enzimatik ve mekanik olarak tek hücre süspansiyonuna ayrıştırılır. Daha sonra bir bazal membran ekstrakt damlasına gömülür ve organoid oluşturmak için özel kültür ortamında büyütülür. Tümör histolojisinin teyidi yapıldıktan sonra, oluşturulan organoidler canlı biyobanklara yerleştirilir ve ilaç taramaları için kullanılır. PDO ilaç tarama tepkisini tanımlamak için çeşitli sonuçlar alınabilir (organoid boyutu, canlılık ve eş kültür sitokin ölçümleri dahil). Tarama yoluyla belirlenen etkili ilaçlar daha sonra hastanın tedavisi için kullanılır.
Mikroakışkan Çipler
Mikroakışkan çip teknolojisi, mikroakışkan ve doku mühendisliği ile insan organlarının ve dokularının mikro modellerini yaratır, bu sayede ilaç etkileşimleri ve toksisitesi üzerine kritik veriler sağlar. Bu mikroakışkan biyoçipler, tümör mikroçevresi ve bağışıklık hücreleri ile olan etkileşimleri modelleme potansiyeli ile dikkat çeker ve bu sayede ilaç yanıtlarını, toksisitesini ve hücre davranışını derinlemesine inceleme olanağı sunar. Bu modeller, hem in vitro hem de in vivo araştırma avantajları ile öne çıkmakta ve bu konuda kapsamlı bir analiz sağlamaktadır.
Hassas Tıbbın Diğer Yönleri
Çevresel, Sosyal ve Davranışsal Faktörler
Çevresel, sosyal ve davranışsal faktörler, bireylerin sağlığı üzerinde belirgin bir etkiye sahiptir ve hassas tıbbın yaklaşımları, genetik faktörlerle birlikte bu unsurları da dikkate almalıdır. Bireyin sağlığı üzerinde yalnızca %30 oranında genetik faktörlerin rol oynadığı ve geri kalanını davranışsal, sosyal, çevresel faktörler ve sağlık hizmetlerinin etkilediği bilinmektedir. Hassas tıp uygulamaları, genetik bilgilerin yanı sıra bu faktörleri de entegre ederek, bireye özel sağlık yönetim stratejileri geliştirmelidir.
Bazı eleştirilere göre, hassas tıbbın henüz nüfus düzeyinde morbidite ve mortalite üzerinde belirgin bir etkisi olmamasının sebeplerinden biri, çevresel ve sosyal faktörlere yeterince odaklanmamış olmasıdır. Etkili ve bütünsel bir hassas tıp uygulaması için, çevresel ve sosyal faktörlerle birlikte, genetik yatkınlıkların dikkate alınması ve bu parametreler arasındaki etkileşimlerin anlaşılması gereklidir.
Bu, özellikle karmaşık ve çok faktörlü hastalıklar söz konusu olduğunda, kistik fibroz gibi tek genli hastalıklara kıyasla daha meydan okuyucu olabilir. Ancak, çeşitli omik bilimlerin, dijital sağlık teknolojilerinin ve büyük veri analitiğinin ilerlemesi ile bu zorlukların aşılabileceği ve kişiselleştirilmiş risk değerlendirmelerinin geliştirilebileceği umulmaktadır. Bu yaklaşım, bireyler için özel olarak kişiselleştirilmiş önleyici ve tedavi stratejileri geliştirmede önemli rol oynayabilir ve bu sayede tıbbın çeşitli alanlarında etkili uygulamalar oluşturabilir.
Elektronik Sağlık Kayıtları
Elektronik Sağlık Kayıtları (ESK), hastaların tıbbi geçmişlerini, tedavi planlarını ve ilaçlarını içeren dijital bilgi sistemleridir ve 1970’lerden bu yana, bilgisayar teknolojisindeki gelişmeler sayesinde evrilmektedir (e-nabız, en bilinen örneğidir). ESK’lerin ilk uygulamaları, faturalandırma ve programlama odaklı olup, zaman içerisinde tıbbi bakım ve araştırma amacıyla geliştirilmiştir. ESK sistemleri, günümüzde, sağlık profesyonelleri, hastaneler, sigorta şirketleri ve hastalar arasında yaygın olarak kullanılmakta olup, hasta-doktor ilişkilerini ve iletişimini de dijital ortamda dönüştürmektedir.
Hassas tıp alanında, ESK’lerin önemi özellikle genomik verilerin entegrasyonu ile artmaktadır. Kişiselleştirilmiş tıp uygulamaları, genomik bilgileri etkin bir şekilde kullanabilmek için ESK sistemlerine önemli ölçüde bağımlıdır. Bu, hastalar için daha spesifik ve kişiselleştirilmiş bakım yaklaşımlarını mümkün kılar ve biyomedikal araştırmalar için yeni olasılıklar sunar.
Ancak, ESK sistemlerinin kullanımı ile ilgili olarak veri doğruluğu, eksik veri ve önyargı gibi konular, araştırmacılar için önemli zorluklar oluşturmaktadır, çünkü bu sistemler aslen araştırma amacıyla oluşturulmamıştır. Ek olarak, genomik verilerin ESK ile entegrasyonu sırasında etik ve bilimsel konular dikkatlice ele alınmalıdır. Ayrıca, ESK sistemlerinin geniş çaplı uygulanabilirliği, özellikle sağlam sağlık ve bilgi teknolojisi altyapısına sahip olmayan gelişmekte olan ülkeler için bir başka meydan okuma oluşturmaktadır.
Dijital Sağlık
Dijital sağlık, sağlık hizmetlerinin verimliliğini artıran ve tıbbı daha kişiselleştirilmiş bir hale getiren bir alandır; bu, bilgi ve iletişim teknolojilerinin geniş bir yelpazesini, ESK'ler, teletıp, mobil sağlık uygulamaları ve giyilebilir cihazlar gibi çeşitli donanım ve yazılım çözümlerini içerir. Bu teknolojiler, hem sağlık hizmeti sunumunu iyileştirme hem de bireylerin sağlık durumlarına dair bilincini artırma potansiyeline sahiptir. Dijital sağlık aynı zamanda, hastaların kendi sağlık verilerini toplamalarına, örneğin FDA onaylı mobil cihazlar ve uygulamalar aracılığıyla, ve bu verileri doktorlarıyla paylaşmalarına olanak tanır. Bu da klinik kararlar ve potansiyel olarak, geniş çaplı sağlık araştırmaları için değerli veri kaynakları oluşturabilir.
Hastaların bu sürece aktif olarak katılmaları, sağlık durumları üzerinde daha fazla kontrol ve anlayış geliştirmelerini sağlar ve bu da sağlıklı davranışları teşvik edebilir ve bakım planlarını daha etkili bir şekilde izlemelerine yardımcı olabilir. Dijital sağlık, omik verilerle birlikte çevresel verilerin entegrasyonunu sağlayarak hassas tıbbın gelişimini de destekler, bu da bütünsel ve kişiselleştirilmiş bakım yaklaşımlarını mümkün kılar. Dijital sağlık, böylece, hastalar, doktorlar ve araştırmacılar arasında etkili bir ortaklık oluşturarak, kişiye özel tıbbın önemli bir boyutunu oluşturur.
İlgili konu: DİJİTAL SAĞLIK neden bir HAYAL KIRIKLIĞI oldu ve bu nasıl düzeltilir?
Büyük Veri Analitiği ve Yapay Zeka
Büyük veri analitiği ve yapay zeka (YZ, artificial intelligence= AI), hassas tıp uygulamalarını destekleyen kritik teknolojilerdir. "Büyük veri" kavramı, biyomoleküler testler, klinik değerlendirmeler, sosyal ve çevresel faktörlerden elde edilen geniş ve çeşitli veri kümelerini içerir ve bu verilerin analizi, hassas tıbbın ilerlemesi açısından merkezi bir öneme sahiptir. Ancak, bu verilerin hacim ve çeşitliliği, analiz ve yönetimi için geleneksel yazılım ve donanım yöntemlerini zorlar.
Büyük veri analitiği, heterojen verilerin birleştirilmesi, kalite kontrolü, analiz, modelleme, ve yorumlama süreçlerini içerir. Dikkate değer bioteknolojik ilerlemeler, geniş ve karmaşık biomedikal veri kümelerinin oluşmasına yol açmıştır. Bu verileri anlamlı bilgilere dönüştürmek için detaylı analitik süreçler gereklidir. Tıp ve sağlıkta büyük veri analitiği, büyük hastalık ve hasta veri setlerinin analizini, veri setleri arasındaki ilişkilerin ve korelasyonların belirlenmesini ve tahminleyici modellerin oluşturulmasını sağlamaktadır. Öte yandan, yapay zeka ve alt kategorileri olan derin öğrenme ve makine öğrenimi, makinelerin insan benzeri düşünme süreçlerini taklit etmelerine olanak tanır.
YZ, sağlık sektöründe geniş ve heterojen sağlık verilerini, multiomik verilerden çevresel ve biyomedikal literatür verilerine kadar, analiz edebilmekte ve zamanında işleyebilmektedir. Bu kapasite, YZ'nin büyük veri kümelerini anlamlandırma ve onları faydalı tanı, tedavi ve terapötik stratejilere dönüştürme potansiyeline sahip olmasını sağlar. Bu nedenle, büyük veri ve YZ, hassas tıbbın ilerleyişi ve sağlık sektöründeki diğer yenilikler için önemli araçlar olarak öne çıkmaktadır.
Sonuç Olarak Hassas Tıbbın Rolü ve Önemi
Son on yılda genetik temelli hastalık anlayışımızdaki büyük ilerlemeler, hassas tıbbın gelişimini ve uygulamasını hızlandırmıştır. Bu da hastalıkları daha detaylı olarak tanımlamamıza ve daha spesifik tedaviler geliştirmemize olanak tanımıştır.
Aşağıdaki tabloda, onkoloji alanında son 10 yıl içinde yaşanan ve klinik pratiğe de etkisi olan önemli anlayış değişikliklerini görebilirsiniz.
Onkolojide 10 Yılda Neler Değişti?
| 2010 | 2020 |
| Kanser klonaldır | Kanser poliklonal |
| Primer kanser-spesifik tedavi | Moleküler işarete özgü tedavi |
| İmmünoterapiler işe yaramaz | İmmünoterapiler mucizevi |
| Bazı hastalar için genetik test | Birçok kişi için geniş kapsamlı genetik test |
| Rastgeleleştirilmiş faz III deneyler | Küçük tek kollu deneyler |
| Mikrobiyom anlamsız | Mikrobiyom gizemli ve güzel |
| Kanser tedavisi pahalı | Kanser tedavisi oldukça pahalı |
Hassas tıbbın etkin bir şekilde işleyebilmesi için hastalıkların farklı alt tiplere ayrılması ve her hastalık alt tipi için spesifik tedavilerin bulunması esastır. Alt tiplendirme ve özelleştirilmiş tedavi stratejileri, klinik fenotiplemeden moleküler alt tiplendirmeye, ve son olarak omik veriler ile klinik verilerin entegre edildiği kapsamlı bir yaklaşıma doğru evrilmektedir.
Hassas tıbbın tam anlamıyla vaatlerini yerine getirebilmesi için, çeşitli bilgi düzeylerinin (moleküler, klinik, laboratuvar ve çevresel veriler) entegrasyonu gereklidir. Bu noktada, büyük veri analitiği ve yapay zeka, bilgi entegrasyonunu gerçekleştirme ve hassas tıbbın geleceğini şekillendirme noktasında kilit bir rol oynayacaktır.
Wang, R. C., & Wang, Z. (2023). Precision Medicine: Disease Subtyping and Tailored Treatment. Cancers, 15(15), 3837.