ABD Gıda ve İlaç İdaresi (FDA), 3 Mayıs 2019'da, HER2-pozitif erken evre meme kanseri ameliyat sonrası adjuvan (koruyucu) tedavisi için ado-trastuzumab emtansin (Kadcyla) adlı ilaca onay verdi. Erken evrede meme kanserinde Kadcyla kullanılması için, hasta neoadjuvan (ameliyat öncesi küçültücü) amaçla taksan ve trastuzumab bazlı tedavi aldıktan sonra rezidü (kalıntı) kanseri olmalı.
Onay, HER2 pozitif erken meme kanseri olan 1486 hastada adjuvan tedavi olarak Kadcyla ve trastuzumabın güvenliğini ve etkinliğini değerlendiren KATHERINE adlı faz-3 klinik araştırmanın verilerine dayanmaktadır.
Özet sonuçlar;
- Ortanca 40 aylık bir takip süresinin ardından Kadcyla alan hastalarda trastuzumab ile karşılaştırıldığında istatistiksel olarak anlamlı bir iyileşme olduğunu göstermiştir (tehlike oranı [HR] 0.50, % 95 CI 0.39-0.64; P <.0001).
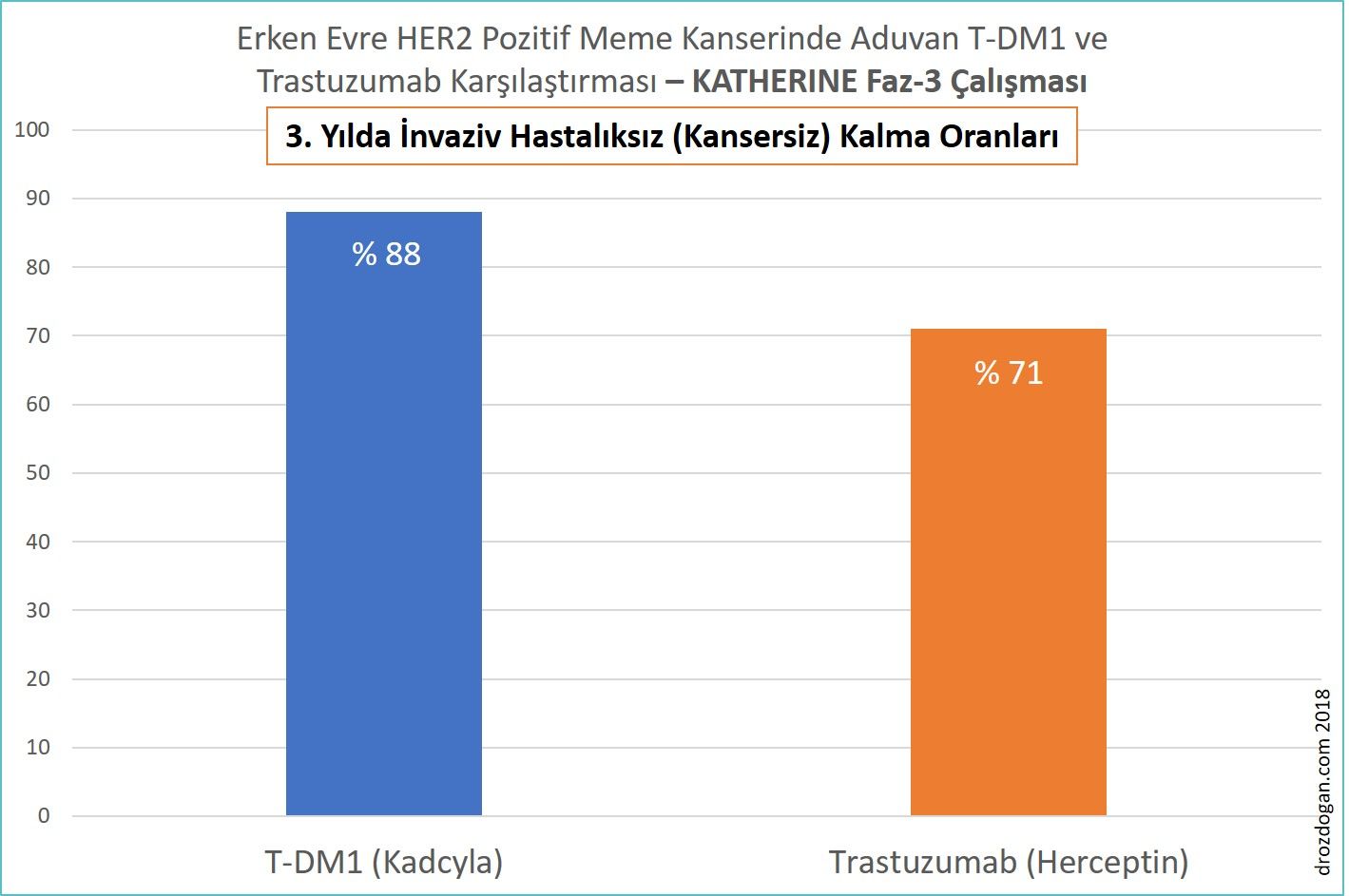
- Ek olarak, 3 yılda Kadcyla alanların % 88.3'ünde, trastuzumab grubunun % 77'sinde meme kanseri nüksü (tekrarı) görülmedi.
Yan etkiler: Kadcyla ile ilişkili en yaygın yan etkiler, halsizlik, bulantı, artmış karaciğer enzimler (ALT, AST), kas-iskelet sistemi ağrısı, kanama, trombositopeni, baş ağrısı, periferik nöropati ve artralji idi.
HER2-hedefli bir antikor ve mikrotubül inhibitör konjugatı olan Kadcyla, daha önce HER2-pozitif, metastatik meme kanserli hastaların tedavisi için FDA onayına sahipti.
Trastuzumab Emtansine Nedir, Nasıl Çalışır?
Diğer adı T-DM1 olan ado-trastuzumab emtansine, iki farklı ilacın kombinasyonundan oluşur:
- T: trastuzumab (hedefe yönelik akıllı ilaç)
- DM1: hücrenin iskeleti mikrotübüller üzerine etkili bir kemoterapi ilacı
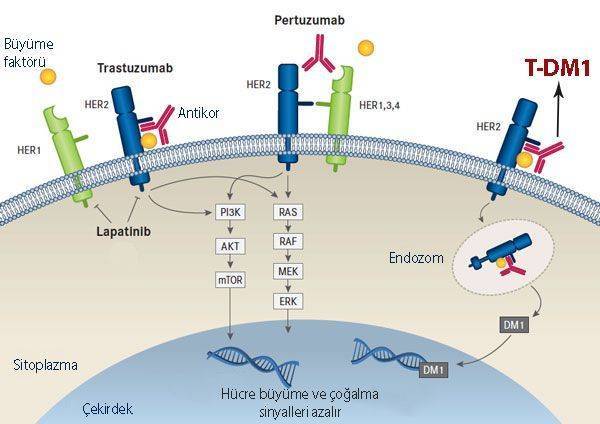
Resmin açıklaması: Kadcyla, insan epidermal büyüme faktörü reseptörü 2 (HER-2) olarak bilinen meme kanseri hücrelerinin yüzeyindeki bir reseptörü hedef alır. Protein yapıdaki bu reseptöre bağlandıktan sonra, hücrelere girer ve hücrenin büyümesini veya bölünmesini durduran DM-1 adlı bir kimyasal maddeyi serbest bırakır.
KATHERINE Çalışmasının Detayları
- Yaklaşık 1500 HER2 pozitif meme kanserli hastanın dahil edildiği oldukça büyük çaplı bir klinik araştırma gerçekleştirildi.
- Tüm hastalar, tanı anında HER2 pozitif erken meme kanserine sahipti. Tümör boyutu T1 ila T4, nodal evre N0 ila N3 ve metastazı olmayan hastalardı (meme kanserinde evreleme için bakınız). T1aN0 veya T1bN0 evreye sahip hastalar çalışmaya alınmadı. Ayrıca, antrasiklin ile veya antrasiklin olmadan bir taksanlı kemoterapi ve en az 9 haftalık trastuzumab dahil olmak üzere neoadjuvan tedaviyi tamamladıktan sonra, ameliyatta memede veya aksillada (koltuk altı) rezidüel hastalık olan hastalar çalışmaya dahil edildi. Daha sonra hastalar, ameliyat sonrası 14 kür adjuvan tedavi (bir gruba T-DM1, diğerine trastuzumab) verilmek üzere rastgele iki kola ayrıldı.
- Araştırmanın erken bir analizinde, T-DM1 grubundaki 743 hastanın 91'inde (% 12) ve trastuzumab grubundaki 743 hastanın 165'inde (% 22) kanser tekrarı veya yaşam kaybı meydana geldi (bakınız aşağıdaki şekil).
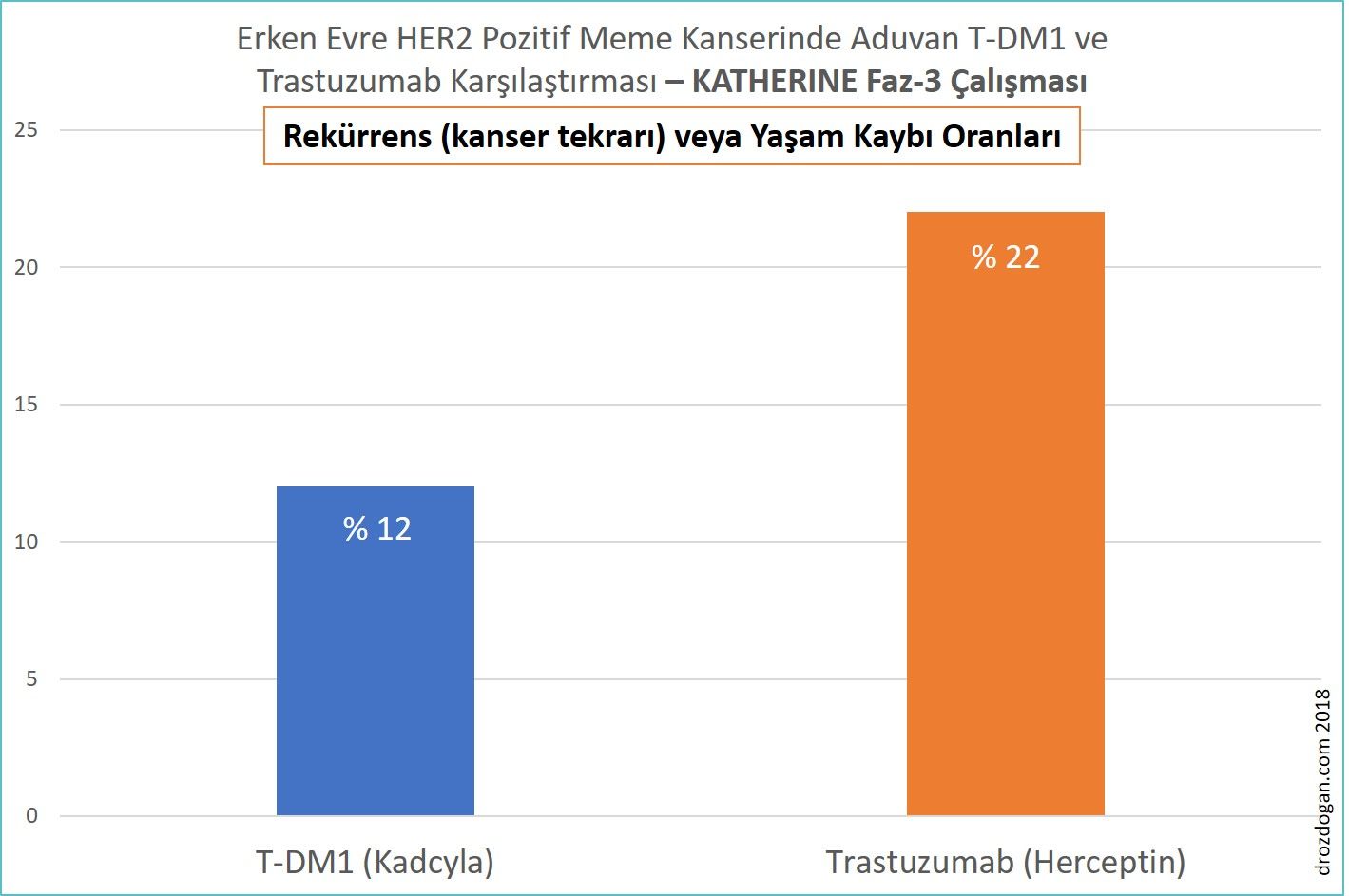
- 3. yılda kansersiz olma oranları T-DM1 grubunda % 88, trastuzumab grubunda % 77 idi. Bu % 11'lik oran, erken evre meme kanseri için oldukça dikkat çekicidir (bakınız aşağıdaki şekil).
- T-DM1'in faydası;
- hem hormon reseptör pozitif ve negatif
- hem farklı rezidüel hastalık düzeylerinde
- hem de neoadjuvan rejimde tek veya çift anti-HER2 hedefli tedavi alanlarda benzer şekilde gözüktü.
- Daha da önemlisi, uzak organ metastazı, T-DM1 alan 78 hastada (% 10.5) ve trastuzumab alan 118 hastada (% 15.9) ortaya çıktı. Ancak, beyin metastazları açısından fark saptanmadı.
- Genel sağkalım yararını belirlemek için daha uzun takip gereklidir. Halen ortanca takip süresi yaklaşık 41 aydır. Bu noktada T-DM1 grubunda 42, trastuzumab grubunda 56 yaşam kaybı vardı.
Kadcyla ile en yaygın (≥ %25) yan etkiler yorgunluk, mide bulantısı, artmış transaminazlar (ALT, AST), kas-iskelet ağrısı, kanama, trombositopeni, baş ağrısı, periferik nöropati ve artralji idi.
Önerilen ado-trastuzumab emtansin dozu, hastalık tekrarı veya kabul edilemez toksisite olmadıkça, toplam 14 kür boyunca her 3 haftada bir (21 günlük siklus) intravenöz infüzyon olarak verilen 3,6 mg/kg'dır.