İmmünoterapi 2.0'ı anlatmaya devam ediyoruz;
Over (Yumurtalık) Kanserinde İmmünoterapilerle Hastalık Seyrini Yavaşlatma Şansı
Dünya genelinde 2012’de 239000 kadın over kanserine yakalanmıştır. 2014 yılı istatistiklerimize göre ülkemizde kadınlarda en sık karşılaşılan 7. kanser türüdür.
Over kanseri erken evrelerde hastalığa özgü şikayetlere sahip olmaması nedeniyle sıklıkla ileri evrelerinde tanı konulan bir kanser türüdür. Cerrahi ve kemoterapiye iyi yanıt vermesine rağmen over kanseri, nüks (hastalık tekrarı) yönünden dikkatli olunması gereken kanser türlerindendir.
2015’te yayınlanan çalışmada; over kanserinin standart kemoterapisi olan platin temelli tedavi sonrasında nüks yaşanan hastalarda nivolumabın yardımcı olabileceği ortaya konmuştur. 20 kadın üzerinde yapılan bu çalışmada bireylerden 3 tanesinin tümörünün gerilediği ve 6 tanesinin ilerlemesinin durdurulduğu gözlenmiştir. 2 kadın tamamen remisyona (hastalık bulgularının kaybolması) girmiştir ve bunlardan bir tanesi over kanserinin görece kemoterapiye daha dirençli formuna (berrak hücreli karsinom) sahiptir.
Bu çalışmalar over kanseri tedavisine immünoterapinin en iyi nasıl entegre edileceğine yönelik yeni çalışmaların önünü açmakta, teşvik etmektedir. Tekrarlayan over kanserine sahip bireylerde nivolumab ve diğer immünolojik ilaçların kombinasyonuyla ilgili çeşitli çalışmalar devam etmektedir.
Lenfomalarda Durum
Hodgkin lenfoma (HL) genellikle PD-1 inhibitörlerine duyarlı bir lenfatik sistem kanseridir. Diğer organ kanserlerine nazaran seyrek görülmektedir. Erkeklerde ve genç erişkinler arasında daha yaygındır.
Klasik HL, hodgkin lenfomanın en yaygın türüdür (%95’i). Klasik HL’nın sağkalım oranları geçtiğimiz kırk yılda geliştirilen tedavilerle yükselmektedir. Çoğu bireyin kemoterapiye cevabı iyidir ve beş yıllık sağ kalım oranı %86’dır. Bununla birlikte; yaklaşık %20 ila %30 hasta tedaviye hiç yanıt vermemekte veya tekrar etmektedir. Bu hastalar; yüksek doz kemoterapiyi takip eden otolog hücre transplantasyonu (ASCT = kendinden alınan kök hücrelerin nakli) gibi daha duyarlı tedaviler gerektirmektedir. Eğer ASCT’yi takiben kanser tekrarlarsa, kemoterapi ve hedefe yönelik ilaçların kombine edildiği yeni bir tedavi rejimi düzenlenir (örneğin brentuximab vedotin).
Mayıs 2016’da nivolumab klasik HL tedavisi için FDA onayı almıştır. Hodgkin lenfomada hücrelerin genetik değişikliğe uğrayarak ilerlemiş formuna Reed-stenberg hücreleri adı verilmektedir. Bu genetik değişiklikler immün cevabı baskılayan kontrol noktası molekülleri olan PD-L1 ve PD-L2’nin çoğalması sonucu oluşur. Bu bilgi bize HL tedavisinde PD-1 kontrol noktası inhibitörleri kullanılabileceği öngörüsünü sunmaktadır.
Başka bir çalışmada tedaviye dirençli veya kanseri tekrarlayan genç HL’li hastalarda pembrolizumabın etkili olduğu görülmüştür. 31 hastanın 20’si remisyona 5’i ise tam remisyona girmiştir. Tedaviyle neredeyse tüm hastaların tümörü gerilemiş ve çoğunda cevap 24 haftadan uzun sürmüştür. Nisan 2016’da tekrarlayan klasik HL tedavisinde pembrolizumab FDA onayı almıştır. Pembrolizumabın ayrıca multiple myelom ve diğer hematolojik kanserlerde etkisi test edilmektedir.
Hasta Seçimi Üzerine Yeni İpuçları
İmmünoterapinin kullanımının genişlemesine rağmen, zor bir biyoloji bulmacası çözülmeye devam edilmektedir.
- Neden kontrol noktası inhibitörleri bazı kanserlerde çok iyi çalışıyorken diğerlerinde hiç etki etmiyor?
- Aynı kanser türüne sahip hastalar arasında neden bazıları immünoterapiye cevap verirken diğerleri cevap vermiyor?
İmmünoterapi araştırmasının bir sonraki bölümü, bu soruların yanıtları üzerine odaklanacaktır. Yüksek maliyet ve klasik kemoterapilere göre sayısı az olsa da bazen ciddi olabilen yan etkileri göz önünde bulundurulduğunda kimlerin tedaviden yararlanacağı kimlerin yararlanamayacağını belirlemek oldukça önemlidir. Bir kanserin tedaviye cevap verip vermeyeceğine dair kesin bilgi bulunmamasına rağmen; birçok vakada doktorlar; hastanın özelliklerine ve kanserinin biyolojik temellerine göre fayda ihtimalini tahmin edebilmektedirler. Bilim adamları immünoterapiye olumlu yanıt vereceği düşünülen biyolojik belirteçlerin çözümlenmesi üzerinde çalışmaktadırlar. Örneğin, yüksek PD-L1 düzeylerine sahip kanserlerin PD-1 kontrol noktası inhibitörlerine iyi yanıt vereceğini PD-L1 yokluğunda ise yarar sağlamayacağı artık öngörmektedirler. Fakat, yumurtalık kanseri ve melanom gibi bazı kanserlerde PD-L1 ile PD-1 kontrol noktası inhibitörlerine cevap arasındaki ilişki tam olarak aydınlatılabilmiş değildir. Bazı klinik çalışmalara göre; bazı akciğer kanserlerinde olduğu gibi PD-L1 seviyesi düşük olsa bile PD-1 inhibitörlerine cevap vermektedir.
Asıl büyük problem PD-1 ve PD-L1 analizlerinin bir standardizasyona bağlanamamış olmasıdır. Hangi tahlilin veya reaktifin en uygun olduğu veya PD-L1 üretiminin sadece kanser hücresinden veya kanser hücresinin yanı sıra çevresindeki dokulardan olup olmadığı gibi sorular net cevaplara kavuşmamıştır. Dahası, bir tahlil ve bir analiz metodu kullanarak ulaşılan sınır çizgileri (cut-off) değişik sayılarla karşımıza çıkmaktadır. Bu sorular; işaretleyicilerin klinik kararlar için yeterince güvenilir kabul edilip edilmemesi sorunundan önce cevaplanmalıdır.
Bu arada araştırmacılar PD-1 kontrol noktası inhibitörlerine cevap olarak küçülen kanserlerin tekrar büyümesine neyin sebep olduğu konusunda da araştırmalar yapmaktadır. Cilt kanseri malign melanom hastaları üzerinde yapılan bir çalışma bazı bağışıklık ilişkili genlerdeki mutasyonların, PD-1 blokajına karşı direnç gelişmesinden sorumlu olabileceğini önermişti.
Kontrol Noktası İnhibitörleri Genomik Kararsızlık (Mikrosatellit İnstabilite = Hipermutasyon) Durumlarında Daha İyi Çalışıyor
Bağışıklık kontrol noktası inhibitörleri ve diğer immünoterapi türleri için biyolojik belirteçler üzerine yapılan araştırmalar halen gelişmekte olmasına rağmen, birkaç önemli ipucu ortaya çıkmıştır.
Birincisi, çok sayıda mutasyona sahip tümörlerin kontrol noktası inhibitörlerine daha duyarlı olduğu görülmektedir. Bunun muhtemel açıklaması, daha fazla mutasyona sahip tümörlerin, bağışıklık sisteminin yabancı olarak tanımladığı daha anormal proteinler (antijenler) oluşturmasıdır.
Mutasyon yükünü değerlendirmek için çeşitli testler önerilmiştir. Bir tanesi, kanser geninin tamamının sıralanmasını ve sadece mutasyon sayısının sayılmasını içerir. Bir diğer yaklaşım, yalnızca seçici bir gen panelini sıralamak ve panel içindeki mutasyon oranını tekrar belirlemektir.
Hipermutasyon denilen çok sayıda mutasyona sahip kanserlere bakıldığında ilk sıralarda; öncelikle tütünün neden olduğu kanserler (örn. akciğer, baş ve boyun, mesane kanseri) veya UV ışınlarına maruz kalma (örneğin, melanom ve baş-boyun kanseri) görülmektedir. Bu nedenle bu kanser türlerinin, klinik araştırmalarda bağışık kontrol noktası inhibisyonunun en etkili olduğu kanserler olarak karşımıza çıkması şaşırtıcı değildir.
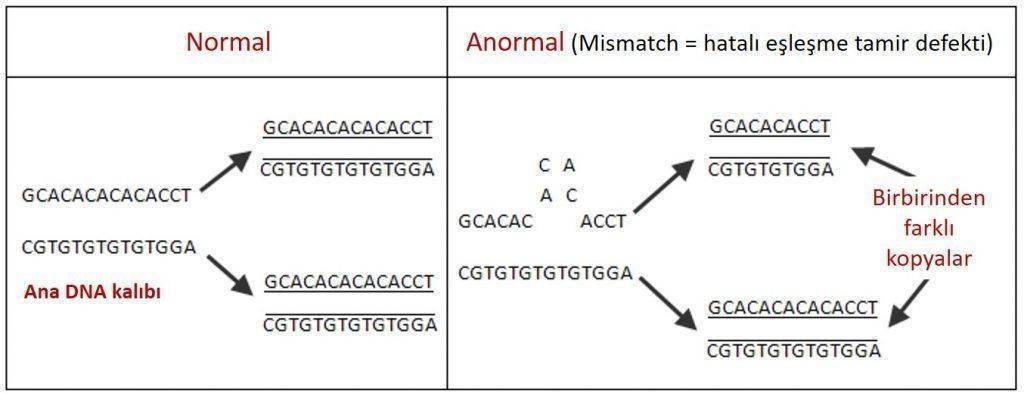
Mikrosatellit oluşması: DNA, her bir nükleotidin karşısına eş nükleotit (örn: adenin (A) karşısına timin (T); sitozin (C) karşısına guanin (G)) getirilerek kopyalanır. 3 milyar nükleotidin eşleştiği bir DNA kopyalanmasında bazı hatalar (örn. yanlış eşleşmeler) olabilmektedir. Bunlar normalde DNA tamir genleri tarafından bulunup onarılmaktadır. Fakat bazı durumlarda hatalı eşleşmeler onarılamaz ve bu durum “hatalı eşleşme onarımı (mismatch repair MMR) defekti" olarak adlandırılır. "Mikrosatellit" olarak adlandırılan eşleşemeyen bu DNA dizileri tekrarlanıp birikir, genomik kararsızlık oluşturur.
Bir hücrenin DNA hasarını onarma yeteneğini zayıflatan, hatalı eşleşme onarımı yetersizliği (DNA missmatch repair (MMR) deficiency) olarak adlandırılan genetik bir anormalliği olan hastaların kanserlerinin birçok mutasyona sahip olduğu tespit edilmiştir. Daha önceki araştırmalar; hatalı eşleşme onarımı yetersizliğine (DNA MMR deficiency) sahip kolorektal veya beyin kanserli hastaların kontrol noktası inhibitörlerinden fayda sağladığını ileri sürmektedir. Bu tedaviler, DNA hatalı eşleşme onarımı yetersizliği olmayan aynı kanserlere sahip hastalarda daha düşük etkinliğe sahiptir.
Genel olarak bakıldığında, bu sonuçlar heyecan vericidir, ancak daha başlangıçtır. Devam eden çalışmaların, kontrol noktası inhibitörü tedavisini, yararlarımı fazla olan hastalara odaklamak için kullanılacak bir veya daha fazla testi belirlemeye yardımcı olacağı umulmaktadır.
DNA MMR defekti kolorektal kanserlerde %15 oranında görülürken, rahim, prostat ve yumurtalık kanserlerinde de görülebilir. 2015'te yapılan bir klinik araştırmada, DNA eşleşme onarımı defekti ve bağışıklık kontrol noktası inhibitörlerine cevap arasındaki ilişki gösterilmiştir. Eşleşme onarımı defekti bulunan kolorektal kanserli hastalar arasında, 10 kişiden 4’ü PD-1 kontrol noktası inhibitörü olan pembrolizumaba cevap vermiştir. Buna karşılık, eşleşme onarımı defekti bulunmayan 18 hastanın hiçbiri pembrolizumaba cevap vermemiştir. MMR defekti olan hastalarda tümör başına ortalama 1.782 mutasyon vardı, oysa olmayanlarda tümör başına sadece 73 mutasyon vardı.
Daha fazla araştırma gerekmekle birlikte, bu erken bulgular, mutasyonel yük olarak adlandırılan, MMR defekti veya tümördeki mutasyon sayısının test edilmesinin, PD-1 / PD-L1 temelli immünoterapiden fayda sağlayacak hastaların belirlenmesine yardımcı olabileceğini düşündürmektedir.
Çocukluk Çağı Beyin Tümörleri
2016'da araştırmacılar, uyuşmazlık onarımına bağlı başka bir kanserin kontrol noktası inhibitörlerine duyarlı olabileceğini bildirdi: tedavisi oldukça zor olan pediatrik glioblastoma multiforme (GBM). GBM'li çocukların çoğu ameliyat, radyoterapi ve kemoterapiye rağmen nükse (hastalık tekrarı) maruz kalmaktadır. Ortalama sağkalım 6 ay olmakla ile birlikte, nükseden GBM'li çocuklar acilen etkili tedavilere ihtiyaç duymaktadır. Yapılan çalışmada, biallelik MMR defekti olarak bilinen nadir görülen çocukluk çağı kanser yatkınlığı sendromuna sahip çocuklara odaklanıldı. Bu sendroma sahip olan tüm çocuklarda yaşamın ilk yirmi yılında, en çok beyin olmak üzere, kan veya mide-bağırsak kanserleri gelişmektedir. Araştırmacılar; farklı dokulardaki 37 biallelik MMR defekti bulunan tümördeki genetik mutasyon oranlarını analiz ettiler. Tüm yüksek dereceli tümörler çok sayıda mutasyona (ortalama 1.589) sahip olmakla birlikte, biallelik MMR defektli GBM'ler en fazla (ortalama 17.740 mutasyon) olarak gözlendi. Biallelik MMR defektli GBM’ler diğer tüm pediatrik ve erişkin beyin kanserleri içerisinde en fazla mutasyona sahip olanı olarak görüldü. Araştırmacılar, çok sayıda mutasyona sahip tümörlerin bağışıklık kontrol noktası inhibitörlerine iyi yanıt verdiğini öne süren önceki araştırmalara göre, pediatrik biallel MMR defektli GBM'de iyi sonuçlar beklemektedir. Bu pilot çalışmada, tekrarlayan biallel MMR defekti olan iki kardeş, nivolumab ile tedavi edilmiştir. Nivolumab ile 12 haftalık tedaviden sonra, her iki çocukta da tümörler küçüldü ve sağlık durumu düzeldi. Sırasıyla 9 ve 5 aylık tedaviden sonra, kız kardeş ve erkek kardeş okullarına ve günlük faaliyetlerine yeniden başlamıştı. Yazarlara göre bu çalışma, tekrarlayan GBM için immün kontrol noktası inhibitörlerine uzun süren yanıtların ilk raporudur.
Bu bulgular cesaret vericidir, çünkü nükseden GBM'li çocukların çoğu sadece 1 veya 2 ayda kötüleşir ve çoğu 3 ila 6 ay içinde yaşamını kaybeder.
Bulgular, MMR defekti olan diğer kanserlerde olduğu gibi GBM’li erişkin hastalarla ilgili de bilgi vermektedir. Daha geniş anlamıyla, bu araştırma kontrol noktası inhibitörü tedavisinde hastaları seçmek için genetik testten yararlanma olasılığının altını çizmektedir.
PD-1 kontrol noktası inhibitörlerine duyarlı nadir kanserlerden bir diğeri de merkel hücreli cilt kanseridir. İleri evre merkel hücreli kanser, oldukça agresiftir ve başlangıç kemoterapisinden itibaren 3 ay içinde kötüleşme gösterir. Diğer cilt kanserlerinde olduğu gibi, merkel hücreli kanser de UV ışınlarına maruziyet sonucu gelişir. Bunun yanında merkel hücreli kanserlerin %80'i Merkel hücreli polyomavirüs enfeksiyonuyla ilişkilidir.