Johns Hopkins Üniversitesi Nöroloji Profesörü Dr. Jaishri Blakeley’e göre, nadir görülen beyin tümörleri için yürütülen üç küçük hedefe yönelik tedavi çalışmasından elde edilen sonuçlar oldukça anlamlı.
Çoğu hasta, hedeflenebilir mutasyonlara sahip olmamasına rağmen, “moleküler genetik testleri yapmaya değer” dedi Blakeley ve ekledi: “Hassas tıp, sonunda nöro–onkoloji için tüm gücüyle burada demek doğru olur diye düşünüyorum.”
Gelecek vadeden bir başlangıç
Bir çalışmada, hastaların 16’sından 15’i (%94) yeni tanı almıştı ve tedavi edilmemiş BRAF V600E mutasyonları barındıran papiller kraniyofarenjiyomlara (PCP’ler) sahiptiler.
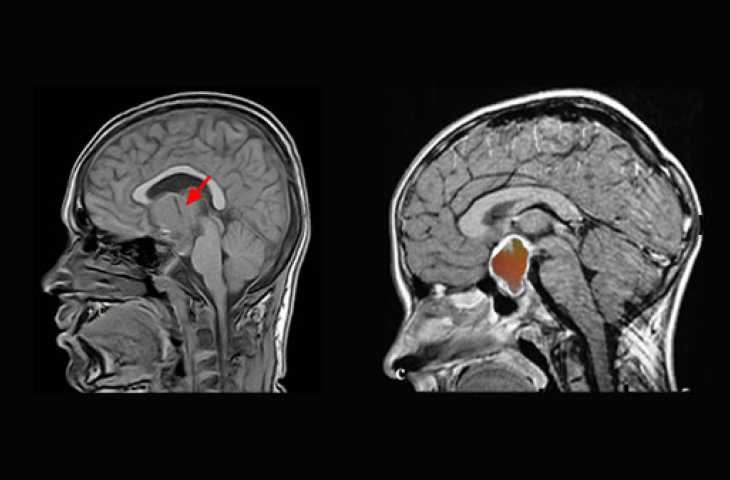
Kraniyofarenjiyom nedir?
Kraniyofarenjiyom, Rathke kesesi artıklarından kaynaklanan ve yavaş büyüme gösteren bir tümördür. Tüm beyin tümörlerinni % 3'ünü oluşturur. Çocuklarda en sık (% 54) ve erişkinlerde
ikinci sıklıkla izlenen suprasellar tümördür. 5-10 yaşlar arasında ve 60'lı yaşlarda iki kere pik yaparak, bimodal bir yaş dağılımı gösterir.
Literatürde kraniyofarenjiyomların iki tipi tanımlanmıştır. Çocukluk çağında izlenen tip: kistik değişiklikler ve kalsifikasyonlar sıktır, adamantinamatöz mikroskobik patern izlenir. Erişkin tip: genellikle iyi bir hastalık gidişatına sahiptir, kalsifikasyon ve kist oluşumu izlenmez, mikroskobik olarak papiller skuamöz epitelyum izlenir.
Tümörün ön görme yollarına yaptığı bası çeşitli göz bulgularına neden olur. En sık rastlanan bulgular; kiyazma basısına bağlı olarak, bitemporal hemianopsi veya inferior kuadranopsi ve optik atrofidir.
Kraniyofarenjiyom için genetik testlere göre tedavi
İlk çalışmada etkli bir tedavisi olmayan papiller kraniyofarenjiyomlu 16 hastadan 15’inde (%94), BRAF V600 mutasyonu saptandı.
- BRAF inhibitörü vemurafenib artı vemurafenib direncini azaltmak için dahil edilen MEK inhibitörü cobimetinib ile tedavi sonrası 14 hastada (%93) tümör %68 – 99 oranında küçüldü.
- 24 aylık progresyonsuz sağkalım %93 idi.
Bu kombinasyon, en az bir tedavi döngüsü alan tüm hastalarda anlamlı yanıtlar ile sonuçlandı.
Çalışmanın araştırmacısı ve sunucusu olan Prof. Priscilla K “Çalışmamız, radyasyon ve ameliyat ile ilişkili morbiditeyi önleme potansiyeli ile birlikte BRAF/MEK inhibitörlerinin daha önce tedavi edilmemiş papiller kraniyofarenjiyom tedavisinde güçlü bir araç olabileceğini göstermektedir.” dedi.
İkinci bir çalışmada 33 kişi, bilinen bir onkojenik faktör olan TRK gen füzyonları pozitif olan yüksek ve düşük dereceli gliomalar veya diğer merkezi sinir sistemi (MSS) tümörlerinin bir karışımına sahipti; büyük çoğunluk çocuktu. Bu kişiler, diğer sistemik tedavilerde ilerledikten sonra TRK inhibitörü larotrektinib ile tedavi edildiler.
- 24 haftada objektif yanıt oranı %30 ve hastalık kontrol oranı %73 idi ve en iyi yanıt için ortanca süre 1.9 aydı.
- Tümörler, değerlendirilebilir hastaların %82’sinde küçüldü.
- Ortanca progresyonsuz (ilerlemesiz) sağkalım 18.3 aydı, genel sağkalıma ulaşılmadı.
Çalışmanın araştırmacısı ve sunucusu olan Monteral Üniversitesi Klinik Nörobilim Profesörü Sebastian Perreault “Bu sonuçlar, özellikle bilinen bir faktör yoksa ve özellikle bebeklerde, MSS tümörü olan tüm hastalar için TRK gen füzyonlarının test edilmesini desteklemektedir.” dedi.
Üçüncü bir çalışma ise crizotinib gibi ALK inhibitörlerini, ALK mutasyonları açısından zengin olduğu bilinen nadir ve neredeyse hep ölümcül bir tümör olan nöroblastoma sahip 7 hastada test etti. Hastalıkları 3.4 ile 37.4 ay arasında sabit kaldı. Progresyona kadar geçen ortanca süre 15.5 aydı ve medyan genel sağkalım 46.5 aydı.
Çalışmanın araştırmacısı ve sunucu olan New York Memorial Sloan Kettering Kanser Merkezi Pediatrik Hematoloji Onkoloji Uzmanı Jessica Stiefel “ALK inhibitörleri, progresyona kadar geçen süreyi uzatarak tedavi için iyi tolere edilen seçenekler olabilirler. Bir ajana karşı olan direnç gelişimi, aynı ilaç sınıfındaki diğer ajanların kullanımını engellemez. Bu tanıya sahip hastaları tedavi ederken ALK inhibitörleri düşünülmelidir.” dedi.
Güçlü bir tavsiye
Veriler, heyet genelinde “harika haberler”dir. Blakeley, doğru MSS tümörüne uygulanan hedefe yönelik tedavinin, tümör kontrolü için önemli fayda sağlayabileceğini söyledi.
Ancak kanser genetik testlerini organize etmek kolay değildir ve “zaman, para ve doku gibi değerli kaynakların” kullanımının potansiyel faydalar ile dengelenmesi için stratejiler gerektirir. Ayrıca test sonuçlarının yorumlanması da kolay değildir.
Olumsuz olaylar da dikkate alınır. PCP çalışmasındaki deneklerin çoğunda 3.-4. derece yan etkiler vardı. ALK inhibitörü çalışmasındaki üç hasta, olumsuz olaylar nedeniyle tedaviyi bırakmak zorunda kaldı. Larotrektinib çalışmasındakilerin yaklaşık %40’ı 3. veya 4. derece yan etkilere sahipti; hiç kimse tedaviyi bırakmadı ama dozları atlamak zorunda kaldılar.
Hedefe yönelik kanser ilaçlarına uygun bir mutasyon tanımlandığında, Blakeley’in “güçlü tavsiyesi”, hastaları bir klinik araştırmaya kaydetmek, tedaviyi güvence altına almak, hastaları yönetmek ve sonuçları değerlendirmek için halihazırda mevcut yapıdan yararlanmaktır.