24 Ekim 2016'da Amerika Gıda ve İlaç Dairesi FDA, 4. evre küçük hücre dışı akciğer kanseri tedavisi için Pembrolizumab adlı immünoterapi ilacının kullanımına onay verdi.
Bu, küçük hücre dışı akciğer kanseri (KHDAK) birinci basamak tedavisinde bir immünoterapi ilacının onay alması açısından dikkat çekici bir gelişmedir.
Böylelikle 4. evre KHDAK tedavisinde pembrolizumab (piyasa adı Keytruda) aşağıdaki şartlarda FDA tarafından kullanım onayı almış oldu:
- Tümörlerinde %50 veya daha fazla PD-L1 ifadesi (ekspresyonu) olan hastalarda birinci basamak tedavi olarak. Bu hastalarda aynı zamanda akıllı ilaçların hedefi olan EGFR veya ALK genomik tümör değişiklikleri bulunmamalı veya daha önce 4. evre küçük hücreli olmayan akciğer kanseri için tedavi almamış olmalı.
- Daha önce bir basamak platin-içerikli kemoterapi aldığı halde hastalığı kötüleşen (progresyon) ve tümörlerinde %1 veya daha fazla PD-L1 ifadesi olan hastalar. EGFR veya ALK genomik tümör değişiklikleri bulunan hastalar da, hastalıkta kötüleşme saptanması halinde pembrolizumab kullanabilir.
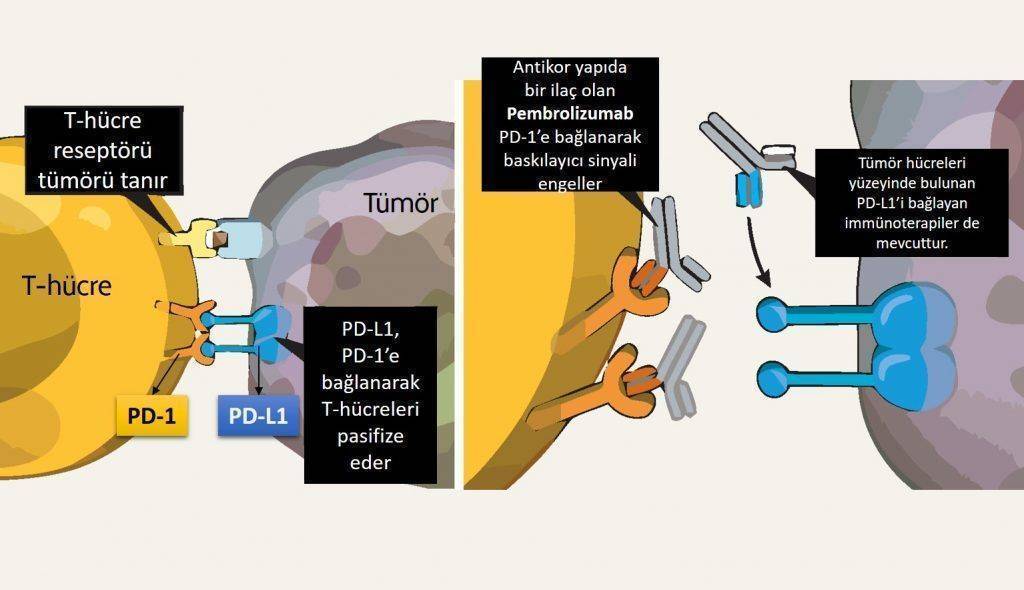
Pembrolizumab'a akciğer kanseri birinci basamak tedavisinde onay getiren çalışmanın detaylarına ulaşmak için tıklayınız.




