
İlaç keşfinde son noktalardan biri – Hedefe yönelik antikor ve kemoterapi konjugatları
Kanser, dünya çapında önde gelen yaşam kaybı nedeni haline geldi. Standart tedaviler kanser hücresinin büyümesinin engellenmesinde ve tümörün ortadan kaldırılmasında önemli etkiler elde etmelerine rağmen, uygulanan ilaçların çoğu, kötü huylu hücreler için sadece küçük bir seçicilik sergilediğinden dolayı, anti-tümör etkinlikte zayıf kalırken ciddi yan etki potansiyeli taşırlar. Bu nedenle, sağlıklı dokuyu etkilemeden tümör hücrelerinin spesifik olarak ele alınması asıl istenen amaçtır. Bazı hücre yüzeyi reseptörleri, kanser hücrelerinde aşırı ifade edilir ve bu nedenle bu reseptörler, tümörü seçecek ve tedavi edecek olan ümit verici hedefler olarak kabul edilebilir.
Kemoterapi ve radyoterapinin olumsuzlukları
Son 60 yıldır kanser tedavisinde ilaç olarak kemoterapi uygulanmaktadır. Bu yaklaşım, hızla bölünen kanser hücrelerini arayan yüksek düzeyde sitotoksik (hücre öldürücü) ilaçlardır. Sistemik olarak uygulanır ve sağlıklı hücrelere de zarar verebilir. Sağlıklı hücrelerin zarar görmesi ile saç dökülmesi, anemi ve morarmalar gibi yan etkiler gözlemlenir.
İlacın sistemik olarak uygulanmasına karşın lokal olarak etki edecek bir tedavi türü olan radyasyon tedavisi (radyoterapi), kemoterapiye nazaran daha lokalize olduğundan uygulandığı/geçtiği bölgede zarara sebep olur. Bu tedavi yönteminin ana prensibi yüksek enerjili radyasyon kullanarak genetik materyale zarar verip daha fazla kanser hücresinin çoğalmasını engellemektir.
Ayrıca anti-tümör etkisini artırılması için sıklıkla radyasyon tedavisi, cerrahi operasyon ve kemoterapi ile entegre bir şekilde uygulanmaktadır. Ancak radyasyon tedavisinin dezavantajı da genetik materyale zarar verdiğinden dolayı ikinci malignitenin gelişme riskini artırması olarak karşımıza çıkmaktadır.
- İlgili konu: Memede radyoterapinin yan etkileri nelerdir, azaltmak için ne yapılır?
Tümör hücrelerinin radyasyona duyarlılığını artırmak için çeşitli yaklaşımlar geliştirilmiştir, ancak bunların tümü, seçici olarak kanser hücrelerini arayan ilaçlara ihtiyaç duymuştur. Bu, kanser hücrelerini sağlıklı dokulardan farklı şekilde işaretleyen biyokimyasal özelliklerden yararlanılarak sağlanabilir.
Örneğin, değiştirilmiş epigenetik düzenleme mekanizmaları, enzimlerin aşırı üretimi veya tümör mikroçevresinde daha düşük bir pH gibi değişiklikler seçici terapötik ilaç iletimi için kullanılabilir. Ayrıca, kanser hücreleri sıklıkla, farklı yapıdaki ligandları bağlayan hücre yüzeyi proteinlerini aşırı eksprese/ifade eder ve bu aşırı eksprese edilen yüzey reseptörleri tümör hücrelerinin çeşitli molekül sınıfları tarafından hedeflenebilmesine izin verir.
Kanserde hedefe yönelik tedavi fikri
Hedefe yönelik tedavi fikri ilk olarak 1908 yılında Nobel Tıp Ödülüne layık görülen Alman bilim insanı Paul Ehrlich tarafından ortaya atıldı.
İlk olarak, vücuda zarar vermeden vücuttaki hastalıklara neden olan patojenleri spesifik olarak öldürme konseptini önerdi. Fikri zamanla gelişti ve önerdiği konsept, kötü huylu hücrelerin ortadan kaldırılması gereken kanser tedavisine aktarıldı. Fikrin ana mantığı, apoptozu tetikleyen ajanların tümör hücrelerini seçebilecek ve bağlanabilecek moleküller ile birleştirilmesidir. Bu konsept oldukça basit gibi görünse de günümüzde hala çözülemeyen bir problem olarak devam etmektedir.
- İlgili konu: KANSER NEDİR? Neden ve nasıl oluşur? Kısaca tüm süreç ve biyoloji
Farklı moleküllerin kanser hücrelerine seçici bir şekilde iletilmesini sağlamak için çeşitli yaklaşımlar araştırılmış ve hala araştırılmaya devam etmektedir.
Seçici ilaç konjugatları
Prensip olarak, ilaç iletimi için kullanılan tüm konjugatlar üç modülden oluşur;
- İlk modül, tümörün hedeflenmesini kolaylaştırır.
- İkinci modül, çeşitli biyolojik işlevleri tetikleyen ilacın kendisidir (çoğu zaman bir kemoterapi ilacı).
- Üçüncü modül, ilk iki modülü birbirine bağlar.
Üç bileşen de genel biyolojik etkinliğe ve seçiciliğe katkı sağlamaktadır.

İlk modül, tümörü hedef alan moleküldür. Küçük moleküller, aptamerler ve polisakkaritler dahil olmak üzere birçok molekül sınıfı bu kapsamda araştırılmaktadır. Bu molekül sınıflarının yanı sıra, monoklonal antikorlar (mAb’lar) en hızlı gelişen ve onay alan ilaç sınıfı olmuştur. Ancak, mAb’ların üretimi çok pahalı ve çok zaman alıcıdır. Ayrıca çoğu, tümöre nüfuz edemeyecek kadar büyüktür ve insanda kullanım için hazırlanmış olsalar da karaciğer ve böbrek gibi organlarda birikme eğilimindedirler.
Not: Bir peptit, kısa bir aminoasit zinciridir. Aminoasitler, peptid bağı adı verilen bağlarla birbirine bağlanır. Tipik olarak peptitler, daha kısa uzunluklarıyla proteinlerden ayırt edilir.
Bu dezavantajların çoğu, peptitler gibi daha küçük biyomoleküller kullanılarak ortadan kaldırılabilir. Peptit – İlaç Konjugatlarının (PİK) taşıyıcı moleküller olarak birçok avantajı vardır. Peptitler, proteolitik enzimler tarafından hızla parçalanabilir ve karaciğer ve böbrek aracılığı ile kan dolaşımından hızla temizlenebilirler. Düşük immünojenisiteye sahiptirler ve toksik olmayan metabolikler ürettikleri için güvenli kabul edilirler. Düşük ağırlıklı molekül oldukları için de katı dokulara daha iyi nüfuz ederek anti-tümör etkilerine yol açabilirler.
Kanser tedavisinde hedef olarak peptitler ve peptit reseptörler
Peptit – İlaç Konjugatında kullanılan peptitler iki kategoriye ayrılabilir;
- Hücreye nüfuz eden peptitler (HPP’ler)
- Hücreyi hedefleyen peptitler (HTP’ler)
Hücre zarı boyunca HPP’lerin hücre içine alım mekanizmaları henüz net olarak anlaşılmamıştır. Ayrıca düşük hücre özgüllüğü nedeni ile de HPP’lerin yaygın uygulaması sınırlıdır.
Aksine HTP’ler, mAb’ler ile aynı yeteneğe sahip olduklarından ideal ilaç taşıyıcı moleküllerdir. HTP’ler, mAb’lerin dezavantajlarını sergilemeden tümör hücresi yüzeyinde aşırı eksprese edilen reseptörlere yüksek afinite (istek) ile bağlanırlar. Ancak, faydalı yüklerin peptit moleküllerine konjugasyonu daha kritiktir, çünkü reseptör bağlanması ve seçiciliği, faydalı yükün sterik talebi nedeni ile etkilenebilir ve bu da reseptör tanımaya müdahale edebilir. Bu nedenle, ilaç paketlerini rasyonel bir şekilde tanıtmak için peptit ve resptör arasındaki etkileşimin kapsamlı bilinmesine ihtiyaç duyulmaktadır.
Yeni ve oldukça etkili anti-kanser ilaçlarının geliştirilmesindeki en büyük zorluk, tümör çevresine seçici ilaç verilirken sağlıklı dokuların korunamamasıdır. Hücre yüzey reseptörleri, seçici tümör hedeflenmesine izin vermek için istenen özellikleri sağladıkları için hedefe yönelik kanser tedavilerinde büyük ilgi görmektedir. Bugüne kadar iki “Peptit – İlaç Konjugatı” kanser tanı ve tedavisinde FDA onayı almış olmasına rağmen, hala aşırı eksprese edilen reseptörlerin hedeflenmesi için yeni Peptit – İlaç Konjugatlarının geliştirilmesinde zorluklar bulunmaktadır (bakınız bu konudaki son FDA onayı loncastuximab tesirine).
Tablo: Hedefe yönelik kanser tedavisinde üzerine çalışmalar yürütülen reseptörler.
|
Reseptör |
Tümör ekspresyonu |
|
Integrin (αvβ3) |
|
|
EGFR |
Yumurtalık kanseri |
|
GPCR’ler |
Meme kanseri Akciğer kanseri Meme kanseri Yumurtalık kanseri İntestinal karsinoidler Bronşiyal karsinoidler |
|
GnHR-R |
Yumurtalık kanseri Meme kanseri Prostat kanseri Akciğer kanseri |
|
VIP reseptörleri |
Kolon kanseri Meme kanseri |
|
MC1R |
|
|
Nörotensin reseptörler (NTSR1) |
Meme kanseri Kolon kanseri Pankreas kanseri Akciğer kanseri Prostat kanseri |
İntegrinler
İntegrinler, hücre yapışmasına, göçüne ve çoğalmasına aracılık etmek için hücre dışı matrisi hücre içi iskeleti ile bağlar. Tüm bu süreçler karsinogenez ile oldukça alakalıdır. İntegrin avp3, öncelikle tümör anjiyogenezi ve metastaz ile ilişkili olduğu için önemli bir anti-kanser hedefi olarak geliştirilmiştir. Integrinler ayrıca, aktive edilmiş endotelyal hücrelerde, yeni oluşan damarlarda (anjiyogenez) ve çeşitli diğer tümör hücrelerinde aşırı eksprese edilir, ancak çoğu yetişkin epitel hücrelerinde bulunmaz.
Epidermal Büyüme Faktörü Reseptörü (EGFR)
EGFR'nin çeşitli kanser türlerinde çok yüksek miktarlarda eksprese edildiği ve kanser hücrelerinin güçlü bir şekilde artmış proliferasyon hızı ile bağlantılı olduğu bulunmuştur. Bu nedenle, birçok monoklonal antikor ve küçük molekül inhibitörü, klinik bir ortamda EGFR'yi hedefleyerek, EGFR'yi inhibe eder ve tümör büyümesini yavaşlatır. EGFR ayrıca, ligand bağlanması ve reseptör dimerizasyonu üzerine interilizasyon davranışı nedeniyle hedefe yönelik ilaç taşınmasında hücre içi alım için bir sistem olarak kabul edilir.
G Proteinine Bağlı Reseptörler (GPCR’ler)
Bu reseptör grubunda 800’den fazla reseptör mevcuttur ve en büyük transmembran protein sınıfını oluşturmaktadır. FDA onaylı hedefe yönelik ilaçların %35’i bu reseptör sınıfı ile ilişkilidir.
Fizyolojik tepki, büyük ölçüde aktive edilmiş G proteinine bağlıdır. İndüklenen sinyalleşme kaskadları hücre içindeki temel süreçleri kontrol ettiğinden, bu sistemdeki problemler genellikle karsinogenez ile ilişkilidir. Bu durumlarda, GPCR’lerin aşırı eksprese edildiği bulunmuştur, bu da tümör hücrelerinin Peptit – İlaç Konjugatları ile spesifik olarak hedeflendirilmesine imkan sağlamaktadır.
Diğer reseptörler
Halihazırda dahil edilen reseptör hedeflerine ek olarak, kanser önleyici ilaç iletimi için potansiyel hedefler olarak bir dizi başka peptit reseptörü de araştırılmaktadır.
Temel olarak hipofizdeki gonadotrop hücrelerde eksprese edilen ancak aynı zamanda lenfositler, meme, yumurtalık ve prostatta bulunan gonadotropin salgılayan hormon reseptörü (GnRH-R) bu alanda çalışma yapılan diğer reseptörlere örnektir. GnRH-R’nin aktivasyonu, gonadotropinler olarak bilinen folikül uyarıcı hormonun (FSH) ve luteinize edici hormonun (LH) salınmasına neden olur. Geçtiğimiz yıllarda, GnRH-R, prostat, endometriyal, epitelyal yumurtalık, mesane, meme, lenfomalar ve akciğer kanserleri gibi çeşitli insan tümörlerinde aşırı ekspresyonu nedeniyle ilaç iletiminde ümit verici sistemler olabilecekleri ortaya konmuştur.
Bir başka örnek de ise Vazoaktif Bağırsak Peptit (VIP) reseptörleri 1 ve 2 yer almaktadır. Kolon, meme ve endokrin tümörlerinde aşırı eksprese edildiği keşfedilmiştir. Doğal ligand VIP ve analogları tümör moleküler görüntülenmesi ve terapötik müdahaleler için uygun hedef olarak kabul edilmektedir.
Melanomların çoğunda yüksek oranda eksprese edilen Melanokortin Reseptörü 1 (MC1R) de geleneksel metastatik melanom kemoterapi tedavisi çok etkili olmadığı için peptit ilaçlar için hedeflenebilecek reseptör olarak kabul edilir.
- İlgili konu: Metastaz nedir? Metastaz belirtileri, Kanser neden metastaz yapar
Son olarak da Nörotensin Reseptörü 1 (NTSR1), meme, prostat, kolorektal, akciğer, karaciğer ve pankreas kanserlerinde aşırı eksprese edildiği bulunmuştur. Ancak doğal ligand nörotensin, metabolik stabilitesinin Peptit – İlaç Konjugatı olarak kullanıma yeterli olmadığından çeşitli toksin ajanlar ile konjuge edilirler.
Akıllı bağlayıcılar teknolojisi
Peptit – İlaç Konjugatlarının tasarımında çok önemli bir başka husus da taşıyıcı molekülleri ve yükü birbirine bağlayan seçilmiş bağlayıcı teknolojidir. Kontrollü salınımı kolaylaştırmak için kanser hücrelerinin biyolojik ortamında çeşitli değişiklikleri kullanan PİK'ler için farklı bağlayıcı stratejiler bildirilmiştir.
Örneğin, tümör hücreleri hızla büyüdüğü ve metabolize olduğu için, tümör damarları genellikle yeterli besin ve oksijen sağlayamaz. Bunun için tümör hücrelerinin içindeki anaerobik glikoliz, tümör dokusunun asitleşmesine neden olan laktik asit üretir. Bu sebepten de pH’a duyarlı bağlayıcılar ile yük salınımı sağlanabilir. En sık kullanılan pH’a duyarlı bağlayıcı hidrazon bağıdır.
Bir başka örnek de redoksa duyarlı bağlayıcıların kullanılmasıdır. Kanser hücrelerindeki glutatyon (GSH) konsantrasyonunun, tümör dokusundaki anormal kan akışının neden olduğu hipoksiye bağlı olarak daha yüksek olduğu bulunmuştur. Bu nedenle disülfür bağları, hedeflenen ilaç dağıtımında yaygın olarak kullanılmıştır.
- İlgili konu: Glutatyon ve kanser – Sır perdesini bilimle aralayalım
Enzimler de yine bu kapsamda kullanılan maddelerdir. Tümör dokularında aşırı eksprese edilen proteazlar tarafından açıkça tanınan bağlayıcılar olarak kısa amino asit dizilerin kullanılmaktadır.
- İlgili konu: Kanser hücrelerinin ölümsüzlük iksiri Telomeraz Enzimi nedir? Kanserde ne gibi önemi vardır?
Hedefe yönelik kanser tedavisinde faydalı yükler
Her bir Peptit – İlaç Konjugatının kalbi, ilaçtır. Peptit ve bağlayıcı yapı, PİK’in seçiciliğini sağlarken, ilaç, konjugatların asıl amacıdır.
Kemoterapötik ajanlar
Bugün kötü huylu kanserleri tedavi etmek için 250'den fazla FDA onaylı ilaç kullanılmaktadır. Bu klasik kemoterapötik ilaçların çoğu, büyük sitotoksisiteleri nedeniyle güçlü farmakolojik aktiviteye sahiptir. Bununla birlikte, bu küçük moleküllerin bir dezavantajı, ciddi yan etkilere neden olan kontrolsüz toksisitesidir.
Bir PİK’in oluşturulması ve uygun bir şekilde kullanılabilmesi için ilaçların belli tasarım ilkelerine uyması gerekir. Ayrıca, kanser hücrelerinin çoğunlukla ilaç direnç mekanizmaları bulunduğundan dolayı, ilacın, malign hücrelere karşı yeterli ve güçlü sitotoksisite sergileyecek şekilde seçilmesi gerekmektedir.
PİK'lerde kullanılan kemoterapötik ajanlar, genel etki tarzlarına göre sınıflandırılabilir;
- İlk molekül grubu hücresel DNA veya DNA-protein komplekslerine bağlanır ve bunlarla etkileşime girer. Bu nedenle, transkripsiyon ve DNA replikasyonu bozulur ve apoptoz indüklenir.
- İkincil molekül grubu DNA biyosentezini inhibe ederek sitotoksisitesini geçirir. Antimetabolitler, örneğin deoksisitidin nükleosit analou, gemsitabin veya enzim dihidrofolat redüktazı inhibe eden folat türevi metotreksat (MTX), kanser hücreleri üzerinde büyük etki göstermiştir.
- Üçüncü grup kemoterapötikler, mikrotübüller üzerinde etkili olan anti-mitotik maddelerden oluşur. Mikrotübül depolimerizasyonunu inhibe eden paklitaksel (PTX) gibi ilaçlar ve tubulin polimerizasyonunu inhibe eden vinca alkaloid analogları bu gruba aittir.
- Diğer bir umut verici molekül grubu, mitoz sırasında iğ ipliklerinin oluşumunu etkileyen kinesin iğ proteini inhibitörlerinden (KSPi) oluşur. Bu süreç bozulduğunda, hücre döngüsü durması indüklenir ve bu da daha sonra apoptoza yol açar. Bu KSP'lerin çeşitli kanser türlerinde oldukça güçlü olduğu bulunmuştur. Bunların klinik ortama aktarılması için özgüllükleri üzerine daha fazla çalışma gerekmektedir.
Radyonüklidler
Kemoterapötik ilaçlar arasında radyonüklidler PİK’lerdeki ikinci ana yük grubudur. Kanserde iki amaç için kullanabilirler; tanı ve tedavi.
PİK’ler PET görüntüleme ajanları oluşturmak için florin, bakır ve galyum gibi pozitron yayan radyoizotplarla veya tek foton emisyonlu bilgisayarlı tomografide kullanılabilen teknesyum ve iyot içeren gama yayan radyoizotoplarla etiketlenebilir.
Tanısal yaklaşımın yanı sıra, radyonüklid etiketli PİK'ler, β yayan, Auger elektron yayan veya α-yayan nüklitler kullanılıyorsa, terapötik olarak da görülebilir.
Bor nötron yakalayıcı tedaviler
Bugüne kadar hedefe yönelik kanser tedavileri için farklı yaklaşımlar geliştirildi ve kliniklere ulaştı. Bu tedavi yaklaşımları, mükemmel anti-tümör etkinliği sergilemesine rağmen ciddi yan etkilerde beklenen azalmayı kısmen başardı. Özellikle spesifik hücre yüzeyi reseptörlerini hedefleyen Antikor – İlaç Konjugatları ateş, mide bulantısı ve kusma, enfeksiyon ve deri döküntüleri gibi yan etkiler gösterir. Bu istenmeyen ve spesifik olmayan etkilerin sebepleri sıklıkla, yüklerini sadece hedefe yönelik tümör bölgesine değil, aynı zamanda hedeflenen belirteçleri de ifade eden sağlıklı dokulara ileten taşıyıcı moleküllerdir. Bu sorunun üstesinden gelmenin bir yolu, tümör hücreleri içinde aktif formlarına dönüştürülmesi gereken toksik olmayan yüklerin kullanılmasıdır. Eğer ikinci adım tümör-selektif ise, toksik yük yalnızca tümör hücrelerinde üretilirken, tüm sağlıklı hücreler yalnızca inaktif yükü içerdikleri için zarar görmez. Bu ilke bor nötron yakalama tedavisi (BNYT) olarak adlandırılan ikili bir radyoterapi yaklaşımında kullanılır.
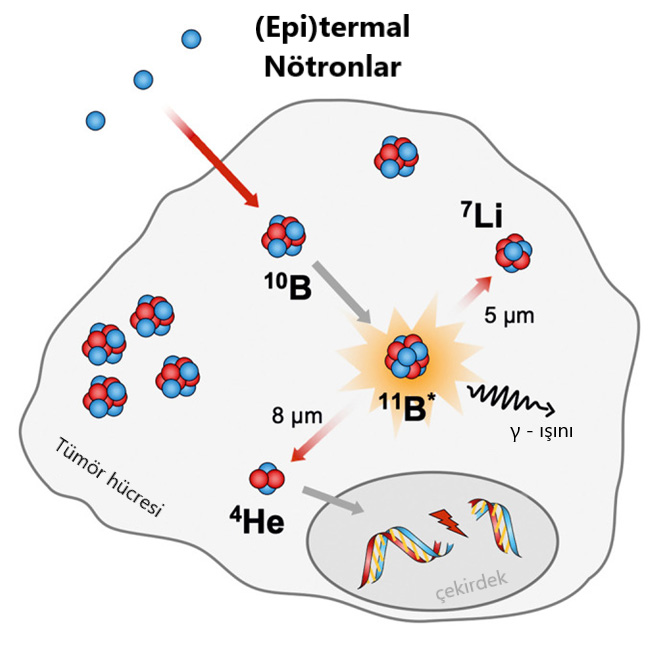
Şekil: Bor nötron yakalama tedavisinde nötron yakalama reaksiyonunun şematik gösterimi.
Bor iletim ajanlarının birkaç kritere sahip olması gereklidir;
- Tümör dokusu tarafından alımının oldukça spesifik olması gerekir
- Bor iletim ajanları nötron ışınlaması süresi boyunca tümör dokusu içinde kalması gerekir
- Eş zamanlı olarak ilacın kandan ve sağlıklı dokudan hızla temizlenmesi gerekir
- Yüklü ajanların kimyasal ve matabolik olarak stabil olması gerekir
- Herhangi bir sitotoksisite içermemesi gerekir
- Uygun bir suda çözünürlüğe sahip olması gerekir
Bu zorlu taleplerin her biri veya özellikle taleplerin kombinasyonları, uygun bor iletim ajanlarının geliştirilmesini zorlaştırmakta ve şu ana kadar klinikte uygulanabilir bir kanser tedavi yöntemi olarak BNCT'nin kullanılmasını sınırlamaktadır.
- İlgili konu: Kanser tedavisinde son nanoteknolojik gelişmeler
Sonuç
Günümüzde anti-kanser ajanlarının hedefe yönelik uygulanması, kanser tedavisi için en çekici yöntemlerden biri olmaya devam etmektedir. Peptit reseptörleri, çeşitli tümör tiplerinde çok aşırı eksprese edilmeleri nedeniyle ümit verici hedefler olarak kabul edilir. Doğal peptit ligandlarının sentetik analogları, yüksek afinite ve spesifiteye, hücre içi hızlı alınım oranlarına ve düşük immünojenikliğe sahip olduklarından PİK'ler için büyük ilgi çekmektedir.
Klasik kemoterapötik ajanlar içeren daha fazla konjugatın klinik çalışmalara doğru ilerlediği görülmektedir. Bu da gelecek kanser tedavilerinde Peptit – İlaç Konjugatlarının uygulanabilirliğini göstermektedir.
Akıllı bağlayıcılar veya bor gibi radyoaktif olmayan yüklere sahip PİK’ler yalnızca daha iyi tümör seçiciliği sağlamakla kalmaz, aynı zamanda daha yüksek etkinlik de gösterebilir. Bu nedenle peptit bazlı ve reseptör aracılı ilaç verme yaklaşımı gelecekte kanser tedavilerine yenilikler katacaktır.
Hoppenz P., Els-Heindl S., Beck-Sickinger A.G. (2020, Jul 07). Peptide-Drug Conjugates and Their Targets in Advanced Cancer Therapies. National Center for Biotechnology Information: https://www.ncbi.nlm.nih.gov/






