Kanser tedavisinde son nanoteknolojik gelişmeler
Dünya çapında yaşam kayıplarının ve düşük yaşam kalitesinin önde gelen sebeplerinden kanser, vücudun diğer bölgelerine de yayılan kontrolsüz hücre çoğalması ile karakterize olan bir hastalıklar grubudur. Hastalığın yayılmasına, yaşam kalitesinin iyileştirilmesine ve yaşam kayıplarının azaltılmasına yönelik çeşitli stratejiler kanser tedavisinde uygulanıyor olmasına rağmen hala tanı ve tedavide doldurulması gereken boşluklar vardır. Bu konuda optimal tedavinin sağlanması, kanserli hücrelerin erken tespiti ve yan etkilerin azaltılması adına atılan adımlar arasında nanoteknolojik stratejiler de yer almaktadır.
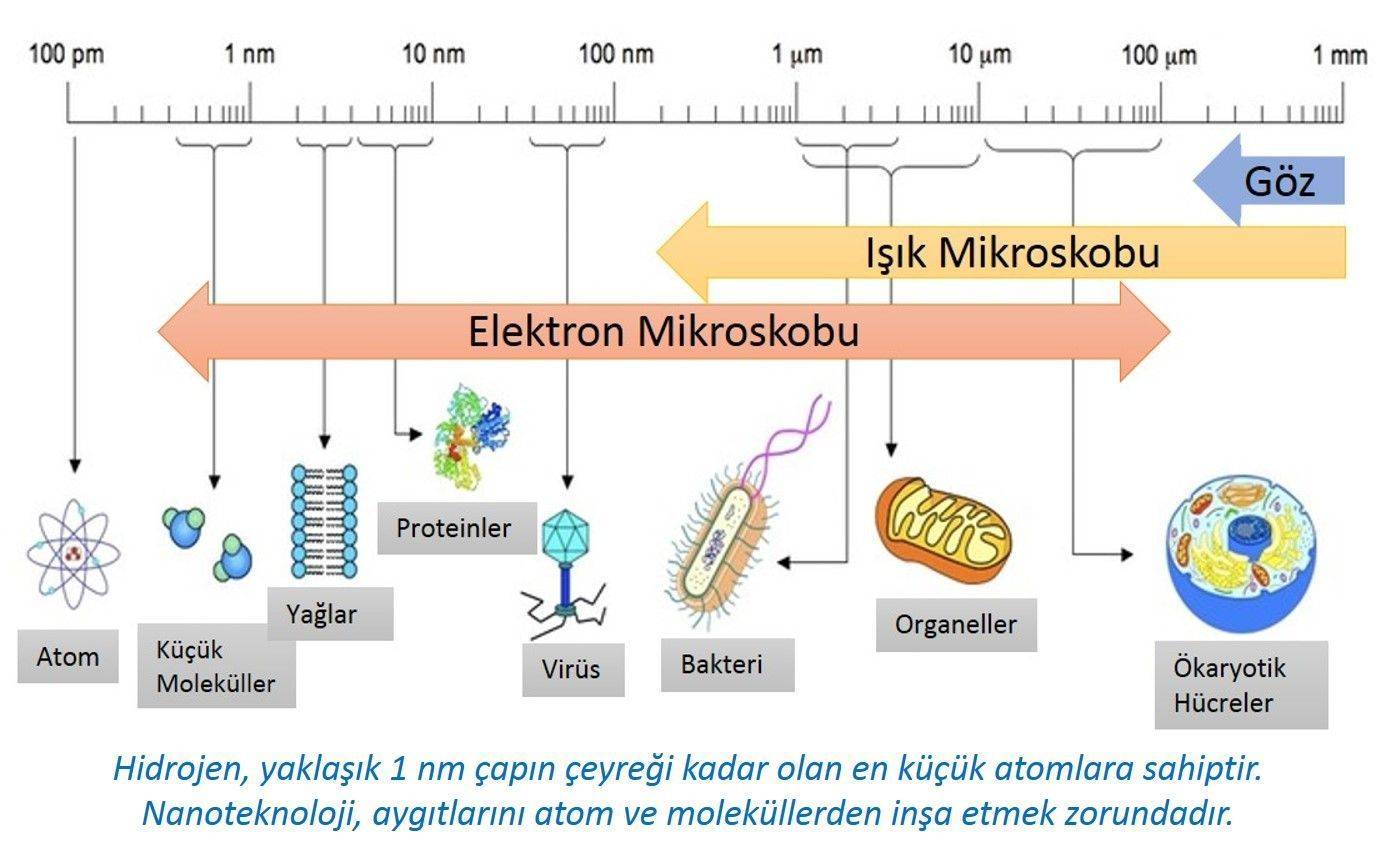
Nanoteknoloji, maddenin atomik ve moleküler seviyede kontrolüdür, bilimin görece olarak yeni bir dalıdır. Nanoteknoloji, “en az bir boyutunun büyüklüğü 1 nanometreden 100 nanometreye kadar olan maddenin kontrolü olarak da tanımlanır.
1 nanometre, 1 metrenin milyarda biridir. 1 nanometre= 0.000000001 veya 10-9 metre olarak da ifade edilir.
Nanoteknoloji kanserde nasıl kullanılıyor?
İdeal taşıyıcı
Nanoteknolojiye dayalı immünoterapötik ajanlar, çeşitli kanser türleri için hedef bölgedeki sağlıklı hücreleri korumak ve kanserli hücrelerin istilasını azaltmak gibi amaçlar için kullanılmaktadır. Benzer amaçla, klasik kemoterapilerin nanoteknolojik formları da artık onkoloji pratiğinde yerini almıştır; örneğin Abraxane. Biyolojik yapıları nedeniyle nanomalzemler hücre bariyerleri kolaylıkla geçebilirler ve aktif ve pasif hedeflendirilebilirler. Nanotüpler, polimerik miseller ve lipozomlar gibi nanomateryaller ayrıca kanser tanı ve tedavisinde önemli farmakolojik faydalara sahip oldukları için ilaç tasarımlarında kullanılmaktadır. Sadece kanser değil, BioNTech ve Moderna firmalarının koronavirüs aşıları, etken maddeleri olan mRNA'ları, nanoteknoloji ile hazırlanan lipozomlarda taşımaktadır.
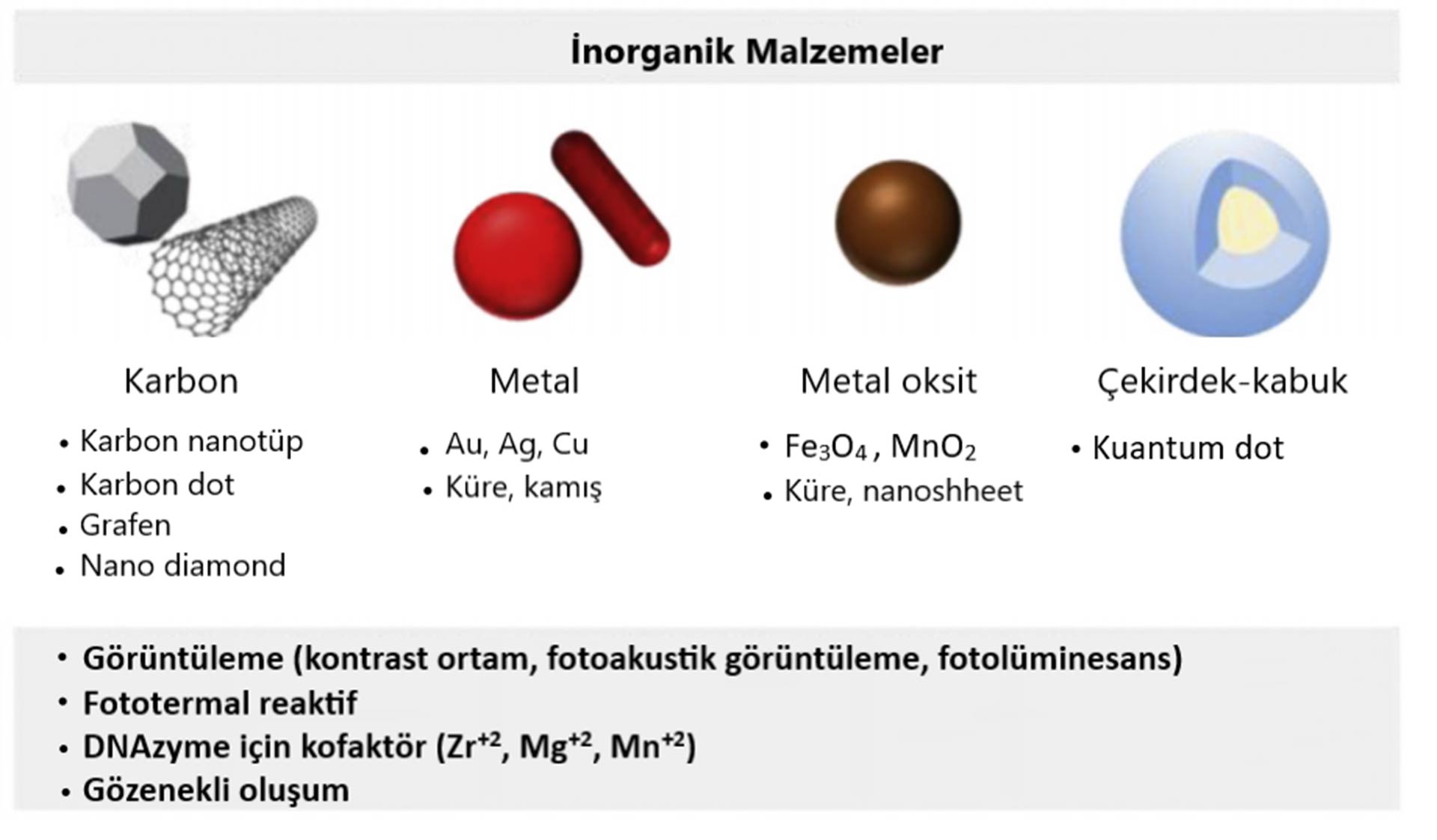
Yaygın olarak kullanılan nanomalzemeler tanı ve tedavi olarak şu şekilde sınıflandırılabilir;
- Tanı;
- Kuantum Dotlar
- Nanoshells (nano kabuklar)
- Altın nanopartiküller
- Tedavi;
- Lipozomlar
- Karbon nanotüpler
- Polimerik miseller
- Dendrimerler
- Kuantum Dotlar
Kanser gen terapilerinde nanoteknolojik yöntemler
Son yıllarda, birçok yaklaşım, kanser hücrelerinde tümör ilerlemesinin önemli faktörlerini susturmanın veya kanserle ilişkili bağışıklık hücrelerini baskılayan genleri devre dışı bırakmanın etkili bir şekilde bir tümöre karşı bağışıklık yanıtı tetikleyebileceğini göstermiştir.
Nanomalzemeler, kansere veya bağışıklık hücrelerine bağışıklık tepkisini düzenlemek için siRNA'ları iletmek için “Truva Atı” gibi kullanılmaktadırlar. Tümör hücresi hedefli siRNA nanoterapötikler, immün-checkpointler (bağışıklık kontrol noktası proteinlerinin), "beni yeme" sinyallerinin, anti-tümör bağışıklık tepkilerini indüklemek için anti-enflamatuar sitokinlerin vb. durumların aşağı regülasyonuna odaklanmaktadır.
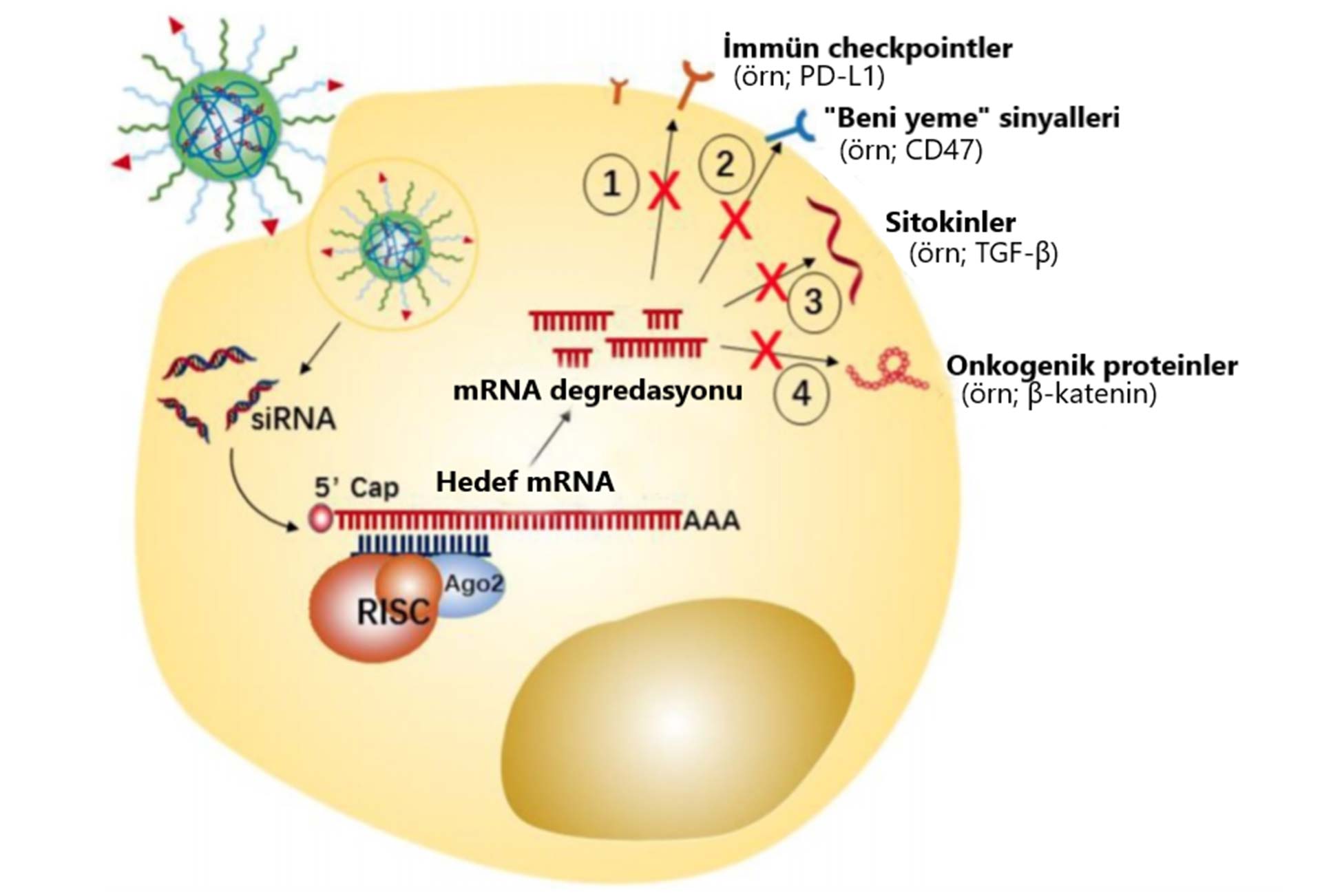
Örneğin; P-glikoprotein (P-gp), ilaca dirençli kanser hücrelerinde ilaç akışını tetikler, bu da gerekli ilaç dozajını artırır ve normal hücrelere zarar verir. Bu nedenle, P-gp mRNA'yı hedefleyen siRNA, tedavi etkilerini maksimize etmek için antikanser maddelerle birlikte kullanılabilir. Melanomu tedavi etmek için anti-kanser ajan paklitaksel ve bir siRNA kombinasyonunu uygulamak için bir lipozomal nanokariyerin kullanıldığı uygulamalar bulunmaktadır.
Bir başka örnek ise geçtiğimiz birkaç yılda siRNA, zararlı hedef genleri susturmak için polimer nano kompleksler aracılığı ile hedefe ulaştırılmasıdır. Prostata özgü zar antijen (PSMA) reseptör ligandını içeren pH'a duyarlı bir hidrofilik polietilen glikol (PEG) kabuk, sistemik olarak siRNA’yı iletmiş ve prostat kanseri büyümesini önemli ölçüde bastırmıştır.
Ek olarak, altın nanopartikül (AuNP) ve siRNA ile konjuge edilmiş küresel nükleik asitler (SNA), onkoprotein olan Bcl2Like12 ekspresyonunu hedeflemiştir. Bu nanopartikül, kan-beyin bariyerini başarı ile geçerek beyne iletimi sağlamıştır ve sonuç olarak, beyin glioblastoma hücrelerinin apoptozunu artırdığı gözlemlenmiştir.
- İlgili konu: Nanoteknoloji ile beyin kanseri kök hücreleri hedef alınıyor
Kanser immünoterapisinde nanoteknolojik yöntemler
Tümör ilerlemesi sırasında, bağışıklık hücreleri ayrıca tümör immünosürveyansı olarak bilinen tümör hücrelerini tanıyabilir ve ortadan kaldırabilir. Bununla birlikte, tümör hücreleri, bağışıklık hücrelerini yeniden eğiterek veya yeniden programlayarak, konağın bağışıklık sistemini değiştirebilir ve bağışıklık sistemi kontrolünden kaçabilir. Bu nedenle, immünosupresif hücrelerin baskılanması veya immün hücrelerin anti-tümörijenik tiplere modüle edilmesi, tümör immün kaçışını baskılamak ve tümör büyümesini yavaşlatmak için ilgi çekici bir yaklaşımdır.
Bağışıklık sisteminin aktivasyonunun artırılmasına odaklanılan tedavi yöntemi olan immünoterapi için de nanopartiküller devreye girer. Örneğin, doğuştan gelen bağışıklık sistemi ve edinsel bağışıklık sisteminin aktivasyonunu artırarak kanserli hücrelere karşı savunmayı teşvik eden CpG-ODN’in (CpG-OligoDeoksiNükleotidler) altın nanopartiküller ile taşınması sonucu daha güçlü bağışıklık yanıtlarının gözlemlendiği çalışmalar bulunmaktadır. Ek olarak, lipid-kalsiyum-fosfat nanopartikülleri, spesifik antijenik bağışıklık tepkilerini tetikleyebildiği ve lipozom-protamin-hyaluronik asit nanopartiküllerinin de siRNA iletimini düzenleyebildiği çalışmalarda gösterilmiştir.
Makrofajlar, patojenleri ve hücresel kalıntıları ortadan kaldırmak için profesyonel fagositlerdir. Tümör mikro ortamında, tümörle ilişkili makrofajlar (TAM'lar) genellikle ya pro-tümör M2 tipi ya da anti-tümör M1 tipidir. Makrofajlar veya monositler genellikle tümör bölgesine alınır ve tümör oluşumunun ilk aşamalarında M1 tipine polarize edilir ve tümörün ilerlemesinde, makrofajlar M1'den M2 tipine dönüşür. CD8+ T hücrelerinin engellenmesine yardımcı olur. Tümör çevresindeki bu yapıları hedeflemek ve dönüşümleri engellemek adına hedefli terapötiklerin gönderilmesi kanser immünoterapisi için umut verici stratejiler olacaktır. Bir bağışıklık sistemi hücresi olan ve aktivasyonu engellenen CD8 + T hücrelerinin aktivasyonunun sağlanması için, dentrik hücreler adjuvanlar ile uyarılabilir. Bir nanopartikül olan poliinosinik-polisitidilik asit (poli I:C) dentrik hücrelere ulaşarak adjuvan görevi görür ve böylelikle bağışıklık hücrelerinin aktivasyonu yine bir nanopartikül aracılığı ile gerçekleştirebilir.
İnterferon gen uyarıcıları (STING), kanser terapötikleri için nanoteknolojik yaklaşım gerektiren bir başka ilgi çekici hedeftir. Hücre içi STING reseptörlerinin, STING sinyal yolunu aktive etmesi gerekir. Bunun için de CGAMP (siklik GMP-AMP) gereklidir. CGAMP iletilmesi ile STING'i aktive edebilecek bir lipozomal nanopartikül, üçlü negatif meme kanseri tedavisi için bir seçenek olabilir.
Başka bir çalışmada STING CDN ligandının sitozolik dağıtımına yardımcı olmak için STING'i aktive eden nanopartikülleri içeren polimer vezikülleri (polimersomlar) sentezlendi. Bu sistemde, cGAMP, endolizozomal asidifikasyondan sonra ayrılan polimerlere verimli bir şekilde kapsüllendi. Daha sonra STING-Nanopatiküller, cGAMP'ın terapötik aktivitesini güçlendirdi, tümör büyümesini kısıtladı ve hayatta kalmayı arttırdı ve ayrıca bağışıklık kontrol noktası inhibisyonuna yanıt verdi.
mikroRNA’lar (mRNA) immün kaçış faktörlerinin ve proinflamatuvar sitokinlerin ekspresyonunu doğrudan inhibe etmek için kullanılabilirler. Birkaç mRNA çeşidinin kanser hücrelerinde PD-L1 (immün checkpoint proteini) ekspresyon seviyelerinde rol oynadığı bulunmuştur. Bugüne kadar, bir anti-tümör bağışıklık tepkisini tetiklemek için mRNA'nın tümör hücrelerine verilmesi için nanoteknolojik yöntemlerin kullanıldığı az sayıda çalışma bulunmaktadır, fakat kanser immünoterapisinin geliştirilmesinde kullanılabilecek potansiyel bir nanoteknolojik stratejidir. Alman BioNTech aşısını geliştiren Uğur Şahin ve Özlem Türeci'nin, kanser tedavisinde mRNA aşıları konusunda önemli çalışmaları bulunmaktadır.
- İlgili konu: Tedaviye dirençli kanserler için çözüm ışığı: Mikro-RNA kullanımı
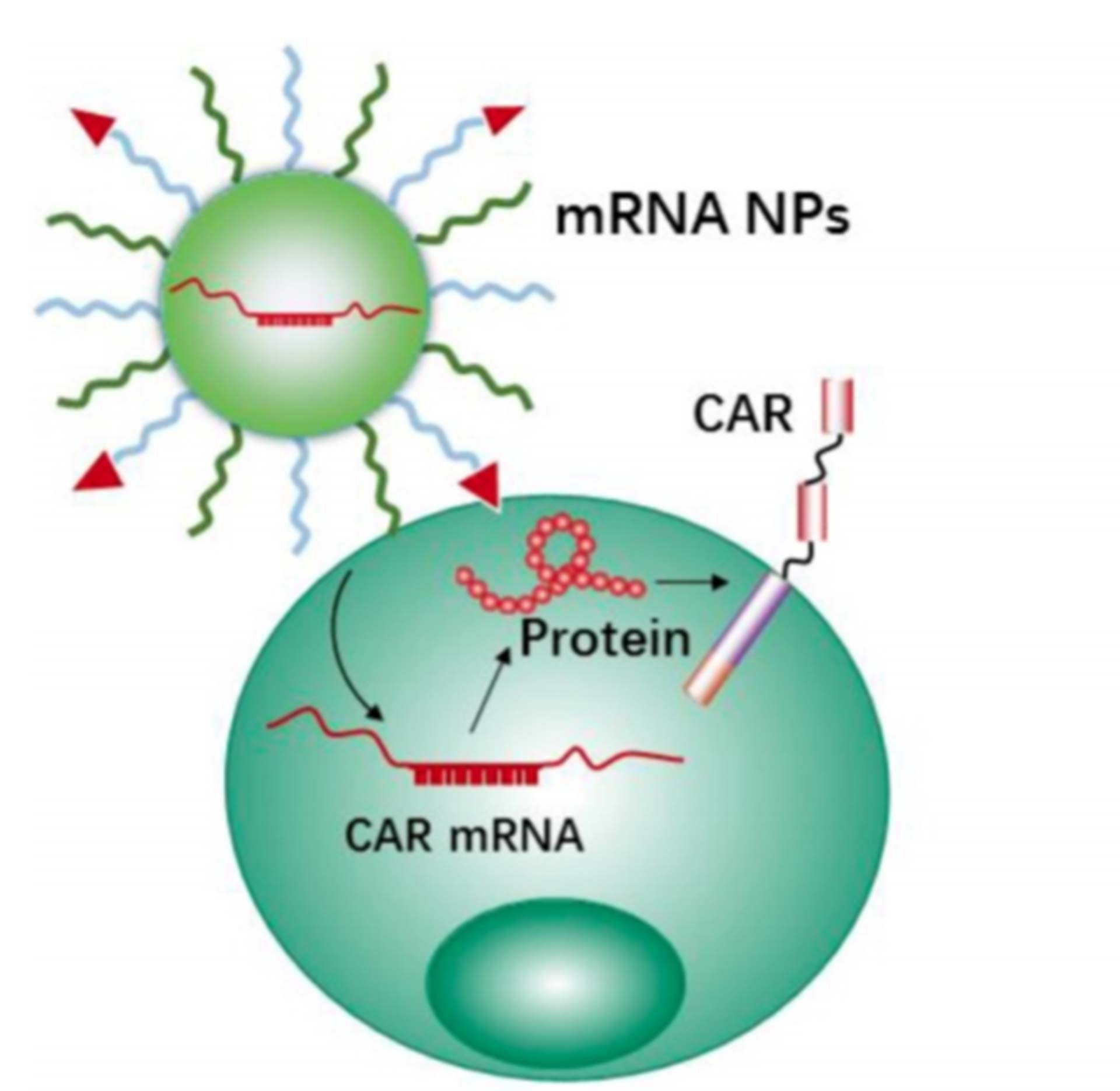
Bir başka yeni immünoterapi yöntemi olarak CAR-T tedavisi ile, lösemi ve lenfoma tedavisi gibi hematolojik maligniteleri (kan kanserleri) olan hastaların tedavisinde büyük başarı elde edildi. CAR programlı lenfositlerde T hücresi reseptörlerini verimli bir şekilde devre dışı bırakmak için genom düzenleme proteinlerini (CRISPR) geçici olarak ifade etmek için mRNA’yı hedefe götürecek nanotaşıyıcılar geliştirildi. Sonuç olarak nanoparitküllerin mRNA'ları hedeflenen T hücrelerine etkili bir şekilde taşıyabildiğini ve ardından hedeflenen T hücrelerinin seçilen proteinleri ifade etmesine yol açtığını gösterildi.
Kanser tanısında kullanılan nanomalzemeler
Kanserde erken tanı, uygulanacak tedaviler yöntemi ve stratejileri hayati derece etkileyebilir. Erken tanı ve bununla birlikte başlayan erken tedavi, kanserli hücrelerin büyümesine ve yayılmasına fırsat tanımadan engelleyebilir.
- İlgili konu: Nanotanecik nedir, örnekleri nelerdir? Kanser tanısında nanoteknoloji
Günümüzde kanserde erken tanı araçları arasında, pozitron emisyon tomografisi (PET), manyetik rezonans görüntüleme (MRI), bilgisayarlı tomografi (BT) ve ultrason kullanılmaktadır. Ancak bu görüntüleme sistemleri, farklı kanser türleri ve evresi hakkında yeterli klinik bilgi sağlanmaması nedeniyle sınırlıdır. Bu nedenle, hangi optimum tedavinin sağlanabileceğine bağlı olarak hastalık durumunun tam bir değerlendirmesini elde etmeyi zorlaştırır.
Bu sebepten uygulanacak tedavi kadar tanı yöntemlerinin de gelişimi daha kapsamlı ve kesin tedavi stratejilerine olanak sağlayacağından kritik öneme sahiptir. Kanser tanısı için tümör dokusunun nanopartiküller ile görüntülenmesi, kanseri erken aşamalarında tespit etmeyi mümkün kılmıştır. Nanoteknolojideki gelişmeler ve bu alanda kullanılan araçlar ile kanser tanısında yeni stratejiler kazandırılmaya devam etmektedir.
- İlgili konu: Kanser tanısı nasıl konur?
Kuantum dotlar
Nesnelere nüfuz etme kabiliyetinin olmaması, görünür spektral görüntülemenin kullanımını sınırlar. Yakın kızılötesi spektrumda floresan yayan kuantum dotlar, bu sorunun üstesinden gelmek için tasarlanmış ve bu da onları kolorektal (kalın bağırsak) kanser, karaciğer kanseri, pankreas kanseri ve lenfomayı görüntülemek için daha uygun hale getirmiştir. Daha yüksek doku penetrasyon (dokuya giriş) derinliğine, daha yüksek uzaysal ve zamansal çözünürlüğe sahip ikinci bir yakın kızılötesi (NIR) pencere de kanser görüntülemeye yardımcı olmak için geliştirilmiştir.
Nanokabuklar
Nanokabuklar, boyutları 10 ila 300 nanometre arasında değişen, genellikle silikondan yapılmış ve ince bir metal kabukla (genellikle altın) kaplanmış dielektrik çekirdeklerdir. Plazma aracılı elektrik enerjisini ışık enerjisine dönüştürerek çalışırlar ve UV-kızılötesi emisyon / soğurma dizileri aracılığıyla optik olarak esnek bir şekilde ayarlanabilirler. Büyük boyutlar ile sınırlı olsalar bile görüntüleme işlemlerinde ağır metal toksisiteleri olmadığından tercih edilirler.
Altın nanopartiküller
Altın nanopartikül (AuNP'ler), küçük boyutu, iyi biyouyumluluğu ve yüksek atom numarası nedeniyle iyi bir kontrast maddesidir. Yapılan son araştırmalara göre AuNP'lerin hücreleri hedeflemek için hem aktif hem de pasif hedefleneme de kullanılabilmektedir. Pasif hedefleme ilkesi, tümör dokularındaki geçirgenlik gerilim etkisi nedeniyle görüntülemeyi geliştirmek için altın nanopartiküllerin bir araya toplanmasıyla yönetilir. Aktif hedeflemeye, tümör hücrelerinin AuNP aktif hedeflemesini sağlamak için AuNP'lerin EGFR hedefli monoklonal antikorlar gibi tümöre özgü hedefli ilaçlarla birleştirilmesi aracılık eder.
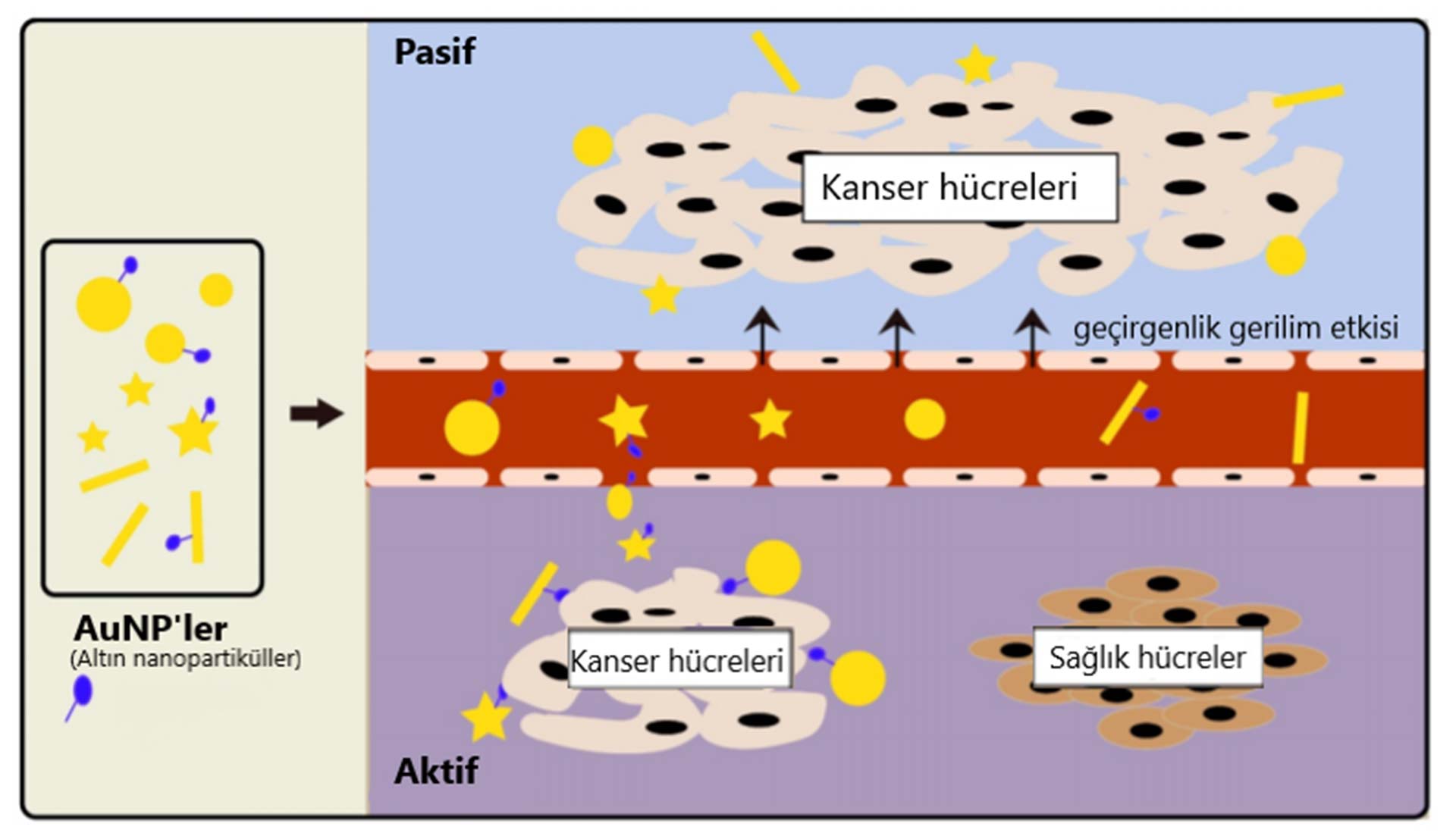
Bir grup araştırmacı karaciğer kanser hücreleri ile AuNP’leri karıştırdı ve X-ışını görüntüleme kullanarak, altın nanokompozit grubundaki karaciğer kanser hücrelerinin, sadece karaciğer hücrelerine göre daha güçlü bir görüntü verdiklerini keşfetti. Bu bulgular, vücutta birkaç milimetre çapında olacak kadar küçük tümörlerin tespit edilmesine olanak sağlayabilir ve bu da erken tanı için oldukça önemlidir.
Biyobelirteçler
Kanser biyobelirteçleri, ekspresyonunun tümörün varlığını ve durumu gösteren biyolojik özelliklerdir. Biyobelirteçler proteinler, protein parçaları veya DNA olabilir. Bu tür belirteçler, kanser hücrelerindeki değişiklikleri izlemek, hücresel süreçleri incelemek veya tanımlamak için kullanılmaktadır ve buradan elde edilen sonuçlar sonuçta tümörlerin daha iyi anlaşılmasına yardımcı olabilmektedir. Kanser taraması için alınan kan, idrar veya tükürük örneklerinde aranan biyobelirteçlerin tamamen yeterli olduğu henüz kanıtlanmadığından daha fazla araştırılma ihtiyacı duyulmuştur. Alınan bu örneklerde anormal olarak eksprese edilen protein, peptit, glikan ve antikorların ekstrakt modelleri proteomik teknolojinin gelişimi ile protein biyobelirteçlerinin keşfine imkan sağlamıştır.
Ancak protein profilleme testlerinde düşük moleküler ağırlığa sahip olan protein biyobelirteçlerinin kaybına neden olan engeller bulunmakta. Bu problemin de ortadan kaldırılmasında nanoteknoloji devreye girmiştir. Kullanılan nanopartiküller ile düşük moleküler ağırlıklı protein biyobelirteçleri yakalanabilen iki farklı çalışma mevcuttur. Ayrıca kütle spektrometresinin hassasiyetinin artırılmasında ve immüno-tarama veya tümör hücrelerinin özelliklerini incelenmesinde de nanoteknolojik çalışmalar bulunmaktadır. Biyobelirteçlerin nanoteknoloji ile taranmasından hala yanlış pozitif ve yanlış negatif sonuçlar nedeniyle daha fazla çalışmaya ihtiyaç duyulmaktadır.
Kanser tedavisinde kullanılan nanomalzemeler
Nanoteknolojinin gelişimi kanser tedavisinde de gelişmeleri beraberinde getirmiştir. Bu gelişmeler küçük moleküler yapıların ve partiküllerin ilaç salınımında bir araç olarak kullanılma imkanı sunmuştur.
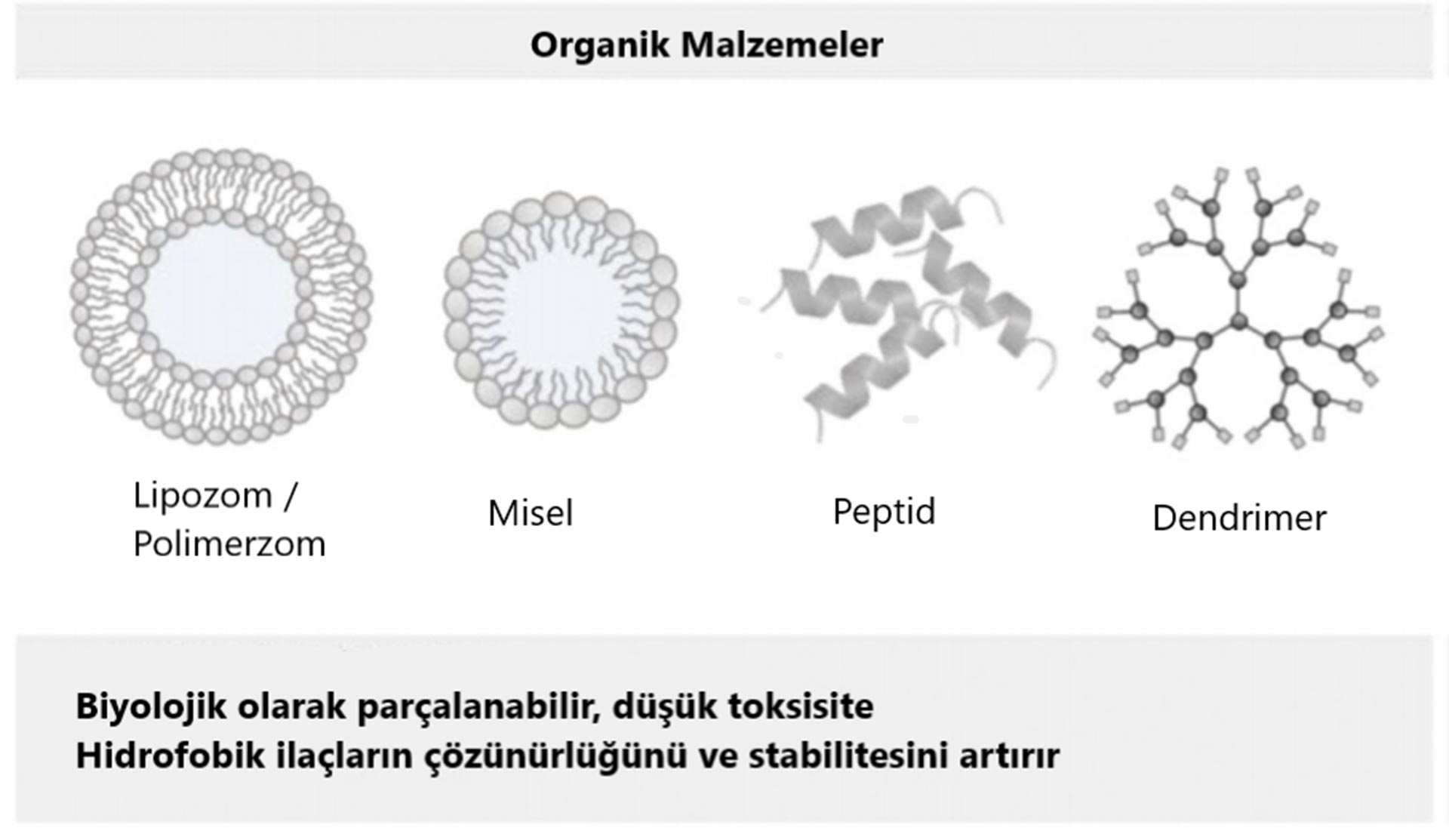
Lipozomlar
İlaç taşıma sistemlerinde kullanılan lipozomlar aktif veya pasif olarak çalışabilir. Pasif hedefleme de tümör dokularındaki geçirgenlik gerilim etkisi altında, damarlardaki boşluklar sayesinde tümör içine girebilir ve burada hücreler ile kaynaşabilir. Hücre içi boşlukta ise ilaç salınımını gerçekleştirebilir. Aktif hedefleme de ise lipozoma bağlı antikorlar, tümöre özgü antijenleri hedefler ve ardından ilaçları tümöre taşıyabilirler.
Ayrıca uygun pH, redoks potansiyeli, ultrasonik ve elektromanyetik alan gibi durumlar sağlandığında da lipozomlar ilaç salınımını aktif veya pasif yollarla gerçekleştirebilir. Boyutlarına göre tümörlere nüfuz etme kabiliyetleri ve yarılanma ömürleri farklılık gösterebilir. Örnek olarak, adriamisinin lipozomal formları, önemli derecede klinik yarar gösterdiklerinden dolayı metastatik yumurtalık kanserinin tedavisi için kullanılmaktadır.
- İlgili konu: Over (yumurtalık) kanseri metastazının mekanizması çözüldü – sırada engel olmak var
Karbon nanotüpler
Karbon nanotüplerin yüzey alanları, metal özellikleri, elektriksel ve termal iletkenlikleri gibi fiziksel ve kimyasal özellikleri nedeniyle, büyük ölçekli biyomedikal uygulamalar için çok uygun bir nanoteknolojik adaydır. Ayrıca yakın kızılötesi ışığı emme yetenekleri ile onların termak etki ile ısınmalarını sağlar ve tümör hücrelerini hedefleyebilirler. Örnek olarak ise paklitaksel gibi ilaçlar ile kombinasyon olarak kanser tedavisinde kullanılmasına yönelik in vitro ve in vivo çalışmalar mevcuttur.
Polimerik miseller
Polimerik nanopartiküller, nanokapsüller veya polimer miseller olarak bilinirler. İlaç taşıma sistemleri için bildirilen ilk polimerlerdir ve hidrofobik ilaçlar ile kullanılırlar. Hidrofobik makromoleküller ve ilaçlar, polimerik nanopartiküllerin merkezine aktarılabilir ve sulu bir çözelti içerisinde enjeksiyon ile terapötik etki sağlayabilir.
Polimerik nanopartiküller potansiyel olarak kanser hücrelerine kıyasla sağlıklı dokularda sitotoksisiteyi (hücre öldürücülük) düşürmek için alternatif yollar sağlayabilir. Ancak kanser nanotıbbı için, ilaçların hedefe sınırlı yan etkiler ve ilaç direnci ile etkili bir şekilde nasıl ulaştırılacağı konusunda hala zorluklar bulunmaktadır. Örneğin, adriamisin ile konjuge nanomateryal, bir dereceye kadar terapötik etkiye ulaşmış ve çeşitli kanser türleri için tedavi amaçlı kullanılmıştır, fakat toksisite ve kalp problemlerinin dahil olduğu birçok yan etki sebebiyle kullanımı sınırlandırılmıştır. Faydaları göz önüne alındığında polimerik miseller ile ilaç hedeflendirmesinin daha güvenli sağlanması için daha fazla çalışma gerekmektedir.
Dendrimeler
Polimerin boyut, yük, çoklu ligand grupları, lipit çift katmanlı etkileşimleri, sitotoksisite, hücre içine alınımı, plazmaya tutma süresi, biyolojik dağılımı ve dendritik makromoleküllerin filtrasyonu dahil olmak üzere fizikokimyasal ve biyolojik özellikleri, dendrimerleri potansiyel nano boyutta taşıyıcılar haline getirmiştir.
Genel olarak, dendritik ilaç konjugatları, antitümör ilaçların dendritik periferal gruplara kovalent bağlanmasıyla oluşturulur. Bu nedenle, her dendritik moleküle birkaç ilaç molekülü bağlanabilir ve bu terapötik moleküllerin salınması, kısmen bu bağlanmanın doğası ile kontrol edilir. Dendrimerlerin ek bir avantajı, DNA-poliamidlerinde görüldüğü gibi DNA'ya bağlanma yetenekleridir ve bu da onları folat reseptörü eksprese kanser hücrelerini öldürmede oldukça etkili kılar.
Kuantum dotlar
Kuantum noktaları vücudun belirli bölgelerinde toplanarak ilaçları bu bölgelere aktarabilir. Kuantum dotların tek bir iç organda konsantre olma yeteneği, onları hedeflenmemiş ilaç dağıtımına karşı potansiyel bir çözüm haline getirir ve kemoterapinin yan etkilerinin de ortadan kaldırılmasına imkan sağlayabilir.
Sonuç
Nanoteknoloji, yıllar içinde kanser tedavisinde çok fazla umut vaat etmiştir. Nanomalzemeler geliştirilmiş farmakokinetik ve farmakodinamik özellikleri ile kanser tanısının ve tedavisinin iyileştirilmesine katkıda bulunmuştur. Nanoteknoloji, özgünlükleri nedeniyle minimum sistemik toksisite ile etkilenen organlarda hedeflenen ilaç salınımına olanak sağlar. Ancak diğer terapötik seçeneklerde olduğu gibi, nanoteknoloji de tamamen toksisitelerden yoksun değildir, bu nedenle klinik uygulamalarda aksamalar olmaktadır. Nanoteknoloji ile ilgili sınırlamalar göz önüne alındığında, ilaç salınımını iyileştirmek, dezavantajları minimumda tutarken etkinliklerini en üst düzeye çıkarmak için daha fazla çalışmalara ihtiyaç vardır. Kullanılan nanomalzemelerin fizikokimyasal özellikleri arasındaki etkileşimleri geliştirerek, kanser yönetiminde tanı ve tedavi için daha güvenli ve daha etkili türevler sağlanabilir.
1. Jin, C. ve ark. (2020, Oct 18). Application of Nanotechnology in Cancer Diagnosis and Therapy - A Mini-Review. National center for biotechnology information: https://www.ncbi.nlm.nih.gov/
2. Jun-OJin ve ark. (2020, May 11). Nucleic acid nanotechnology for cancer treatment. Science Direct: https://www.sciencedirect.com/
3. Lin, Y.-X. ve ark (2020, Jan 1). RNA Nanotechnology-Mediated Cancer Immunotherapy. National center for biotechnology information: https://www.ncbi.nlm.nih.gov/